题目内容
(2009?静安区二模)利用化工厂生产硼砂的废渣--硼镁泥可制取七水硫酸镁(MgSO4?7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2 两种盐的溶解度(g/100g水)
硼镁泥制取七水硫酸镁的工艺流程如下:
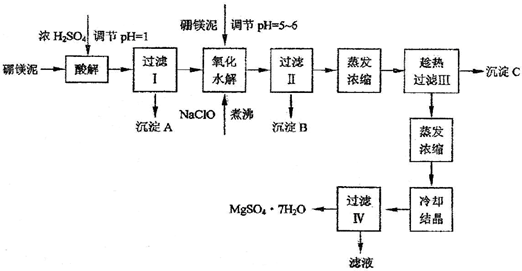
根据以上流程图并参考pH数据和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是
a.被钝化 b.被氧化 c.被溶解
(2)往过滤Ⅰ得到的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液可将溶液中的Mn2+氧化成MnO2,该反应的离子反应方程式为
(3)沉淀B中除MnO2外还含有
(4)沉淀C的化学式是
(5)过滤出MgSO4?7H2O晶体的滤液中含有的金属阳离子有
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |

根据以上流程图并参考pH数据和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是
bc
bc
(选填序号).a.被钝化 b.被氧化 c.被溶解
(2)往过滤Ⅰ得到的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液可将溶液中的Mn2+氧化成MnO2,该反应的离子反应方程式为
Mn2++ClO-+H2O═MnO2↓+2H++Cl-
Mn2++ClO-+H2O═MnO2↓+2H++Cl-
.加热煮沸的目的是促进Al3+、Fe3+水解
促进Al3+、Fe3+水解
.(3)沉淀B中除MnO2外还含有
Fe(OH)3、Al(OH)3
Fe(OH)3、Al(OH)3
(填化学式)等物质.(4)沉淀C的化学式是
CaSO4?2H2O或CaSO4
CaSO4?2H2O或CaSO4
;产生沉淀C的操作需趁热进行的原因是以防MgSO4在温度低时结晶析出
以防MgSO4在温度低时结晶析出
;洗涤沉淀需要的玻璃仪器有:烧杯、漏斗、玻璃棒
漏斗、玻璃棒
;若用乙醇代替水作洗涤剂洗涤沉淀C,原因是降低CaSO4?2H2O的溶解度(或减少CaSO4?2H2O的溶解)
降低CaSO4?2H2O的溶解度(或减少CaSO4?2H2O的溶解)
.(5)过滤出MgSO4?7H2O晶体的滤液中含有的金属阳离子有
Mg2+、Na+
Mg2+、Na+
,生产中对该滤液的处理方法是循环利用
循环利用
;检验滤液是否含有SO42-操作是取滤液1~2mL于试管中,加入BaCl2溶液,若有白色沉淀生成,说明有SO42-.
取滤液1~2mL于试管中,加入BaCl2溶液,若有白色沉淀生成,说明有SO42-.
.分析:(1)氧化亚铁是金属氧化物,亚铁离子有还原性,根据金属氧化物和还原性离子的性质确定氧化亚铁发生的变化;
(2)次氯酸钠有强氧化性,二价锰离子被氧化生成二氧化锰,同时自身被还原,弱根离子水解是吸热反应,温度越高,水解程度越大;
(3)根据表1确定沉淀B的成分;
(4)根据表2确定沉淀C的成分,根据硫酸镁和温度的关系分析,根据仪器的作用选取仪器,根据相似相溶原理知,硫酸钙在水中的溶解度大于在乙醇中的溶解度;
(5)溶液中存在可溶性的阳离子,为节约资源,应循环利用,用盐酸酸化的氯化钡检验硫酸根离子.
(2)次氯酸钠有强氧化性,二价锰离子被氧化生成二氧化锰,同时自身被还原,弱根离子水解是吸热反应,温度越高,水解程度越大;
(3)根据表1确定沉淀B的成分;
(4)根据表2确定沉淀C的成分,根据硫酸镁和温度的关系分析,根据仪器的作用选取仪器,根据相似相溶原理知,硫酸钙在水中的溶解度大于在乙醇中的溶解度;
(5)溶液中存在可溶性的阳离子,为节约资源,应循环利用,用盐酸酸化的氯化钡检验硫酸根离子.
解答:解:(1)浓硫酸有强氧化性,氧化亚铁是金属氧化物,能和硫酸反应生成盐,所以氧化亚铁能溶解,亚铁离子检验还原性,浓硫酸有强氧化性,所以亚铁离子能被浓硫酸氧化,即氧化亚铁被氧化,
故选:b c;
(2)根据题意知,二价锰离子反应后生成二氧化锰,次氯酸根离子生成硫离子,结合原子守恒得,该离子反应方程式为:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,铝离子和铁离子水解是吸热反应,加热能促进铝离子和铁离子水解,从而生成氢氧化铝和氢氧化铁,
故答案为:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,促进Al3+、Fe3+水解;
(3)根据表1知,pH=5-6时,氢氧化铝和氢氧化铁完全生成沉淀,所以B沉淀的成分还有Fe(OH)3、Al(OH)3
,
故答案为:Fe(OH)3、Al(OH)3;
(4)根据表2知,硫酸钙随着温度的升高其溶解度降低,所以沉淀C是硫酸钙;
温度越低硫酸镁的溶解度越小,为减少硫酸镁的析出和硫酸钙的溶解,产生沉淀C的操作需趁热进行;
洗涤沉淀需要的玻璃仪器有:起过滤作用的漏斗、起搅拌和引流作用的玻璃棒;
硫酸钙在无机溶剂中的溶解度大于在有机溶剂中的溶解度,所以为降低硫酸钙的溶解度,用乙醇代替水作洗涤剂洗涤沉淀C,
故答案为:CaSO4?2H2O或CaSO4;以防MgSO4在温度低时结晶析出;漏斗、玻璃棒;降低CaSO4?2H2O的溶解度(或减少CaSO4?2H2O的溶解);
(5)加入的次氯酸钠中含有钠离子,硫酸钠和硫酸镁是可溶性盐,所以过滤出MgSO4?7H2O晶体的滤液中含有的金属阳离子有Mg2+、Na+;
滤液中含有镁离子,生产的原料中需要镁离子,所以为减少资源的浪费,镁离子可以循环利用;
硫酸根离子的检验方法是:取滤液1~2 mL于试管中,加入BaCl2溶液,若有白色沉淀生成,说明有SO42-,否则没有;
故答案为:Mg2+、Na+;循环利用;取滤液1~2 mL于试管中,加入BaCl2溶液,若有白色沉淀生成,说明有SO42-.
故选:b c;
(2)根据题意知,二价锰离子反应后生成二氧化锰,次氯酸根离子生成硫离子,结合原子守恒得,该离子反应方程式为:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,铝离子和铁离子水解是吸热反应,加热能促进铝离子和铁离子水解,从而生成氢氧化铝和氢氧化铁,
故答案为:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,促进Al3+、Fe3+水解;
(3)根据表1知,pH=5-6时,氢氧化铝和氢氧化铁完全生成沉淀,所以B沉淀的成分还有Fe(OH)3、Al(OH)3
,
故答案为:Fe(OH)3、Al(OH)3;
(4)根据表2知,硫酸钙随着温度的升高其溶解度降低,所以沉淀C是硫酸钙;
温度越低硫酸镁的溶解度越小,为减少硫酸镁的析出和硫酸钙的溶解,产生沉淀C的操作需趁热进行;
洗涤沉淀需要的玻璃仪器有:起过滤作用的漏斗、起搅拌和引流作用的玻璃棒;
硫酸钙在无机溶剂中的溶解度大于在有机溶剂中的溶解度,所以为降低硫酸钙的溶解度,用乙醇代替水作洗涤剂洗涤沉淀C,
故答案为:CaSO4?2H2O或CaSO4;以防MgSO4在温度低时结晶析出;漏斗、玻璃棒;降低CaSO4?2H2O的溶解度(或减少CaSO4?2H2O的溶解);
(5)加入的次氯酸钠中含有钠离子,硫酸钠和硫酸镁是可溶性盐,所以过滤出MgSO4?7H2O晶体的滤液中含有的金属阳离子有Mg2+、Na+;
滤液中含有镁离子,生产的原料中需要镁离子,所以为减少资源的浪费,镁离子可以循环利用;
硫酸根离子的检验方法是:取滤液1~2 mL于试管中,加入BaCl2溶液,若有白色沉淀生成,说明有SO42-,否则没有;
故答案为:Mg2+、Na+;循环利用;取滤液1~2 mL于试管中,加入BaCl2溶液,若有白色沉淀生成,说明有SO42-.
点评:本题考查化学与技术,涉及离子的检验方法、仪器的选取、物质的分离等知识点,注意阅读题给信息并充分利用信息进行解答,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目