题目内容
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2=2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑
①该反应中的氧化剂是________,还原剂是________,每生成1 mol Na2FeO4转移________mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用__________________________________
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________
________________________________________________________________________。
②每生成1 mol FeO42—转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题_______________________________________________。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2=2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑
①该反应中的氧化剂是________,还原剂是________,每生成1 mol Na2FeO4转移________mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用__________________________________
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________
________________________________________________________________________。
②每生成1 mol FeO42—转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题_______________________________________________。
(1) ①Na2O2 Na2O2和FeSO4 5
②高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降
(2) ①2Fe(OH)3+ 3ClO-+ 4OH-=2FeO42—+3Cl-+ 5H2O ②3 0.15 mol
③该温度下K2FeO4比Na2FeO4的溶解度小
②高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降
(2) ①2Fe(OH)3+ 3ClO-+ 4OH-=2FeO42—+3Cl-+ 5H2O ②3 0.15 mol
③该温度下K2FeO4比Na2FeO4的溶解度小
(1) ①该反应中得电子的物质是过氧化钠,失电子的物质是过氧化钠和硫酸亚铁,所以氧化剂是过氧化钠,还原剂是过氧化钠和硫酸亚铁;
2FeSO4+ 6Na2O2=2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑转移电子
2 mol 10 mol
1 mol 5 mol
所以每生成1 mol FeO42—转移电子5 mol。
②高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降。
(2) ①高铁酸钾是生成物,氢氧化铁是反应物,根据高铁酸钾和氢氧化铁中铁元素化合价的变化知氢氧化铁是还原剂,而氧化剂得电子反应后元素的化合价降低,根据所给离子中化合价变化的另一种元素是氯,且次氯酸根离子作反应物,氯离子作生成物,所以离子方程式为2Fe(OH)3+ 3ClO-+ 4OH-= 2FeO42—+ 3Cl-+ 5H2O。
②2Fe(OH)3+ 3ClO-+ 4OH-=2FeO42—+3Cl-+ 5H2O转移电子
2 mol 3 mo l 6 mol
1 mol 3 mol
0.15 mol 0.3 mol
因此每生成1 mol FeO42—转移3 mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为0.15 mol。
③该温度下K2FeO4比Na2FeO4的溶解度小。
2FeSO4+ 6Na2O2=2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑转移电子
2 mol 10 mol
1 mol 5 mol
所以每生成1 mol FeO42—转移电子5 mol。
②高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降。
(2) ①高铁酸钾是生成物,氢氧化铁是反应物,根据高铁酸钾和氢氧化铁中铁元素化合价的变化知氢氧化铁是还原剂,而氧化剂得电子反应后元素的化合价降低,根据所给离子中化合价变化的另一种元素是氯,且次氯酸根离子作反应物,氯离子作生成物,所以离子方程式为2Fe(OH)3+ 3ClO-+ 4OH-= 2FeO42—+ 3Cl-+ 5H2O。
②2Fe(OH)3+ 3ClO-+ 4OH-=2FeO42—+3Cl-+ 5H2O转移电子
2 mol 3 mo l 6 mol
1 mol 3 mol
0.15 mol 0.3 mol
因此每生成1 mol FeO42—转移3 mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为0.15 mol。
③该温度下K2FeO4比Na2FeO4的溶解度小。

练习册系列答案
相关题目


 KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。
KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。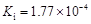



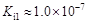 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O ,试配平上述化学方程式。
,试配平上述化学方程式。