题目内容
6.如图1是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出).其中,I是地壳中含量最高的金属,K是一种红棕色气体,E是一种红褐色沉淀.请填写下列空白: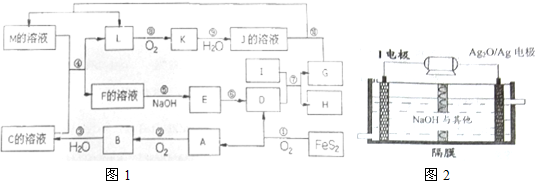
(1)欲检验F溶液中是否含有少量M,可选择的试剂为酸性KMnO4溶液(填化学式).
(2)在反应⑦中还原剂与氧化剂的物质的量之比为2:1.
(3)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色,写出与上述变化过程相关的离子方程式:2Fe3++2I-=2Fe2++I2.
(4)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,该反应的化学方程式是Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.
(5)I电池性能优越,I-Ag2O电池用作水下动力电源,其原理如图2所示,该电池反应的化学方程式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O.
分析 FeS2与氧气反应生成Fe2O3与SO2,E是一种红褐色沉淀,应为Fe(OH)3,可以转化得到D,则D为Fe2O3,A为SO2,A继续氧化生成B为SO3,C为B的水化物,则C为H2SO4.ⅠI是地壳中含量最高的金属,则I为Al,I与氧化铁反应生成Fe与氧化铝,K是一种红棕色气体,应为NO2,则L为NO,J为HNO3,硝酸与G反应生成M与NO,则G为Fe、H为Al2O3,M与C(浓硫酸)反应得到L(NO)与F,F与氢氧化钠反应可得Fe(OH)3,则G为Fe、H为Al2O3,M为Fe(NO3)2,F为铁盐,据此解答.
解答 解:FeS2与氧气反应生成Fe2O3与SO2,E是一种红褐色沉淀,应为Fe(OH)3,可以转化得到D,则D为Fe2O3,A为SO2,A继续氧化生成B为SO3,C为B的水化物,则C为H2SO4.ⅠI是地壳中含量最高的金属,则I为Al,I与氧化铁反应生成Fe与氧化铝,K是一种红棕色气体,应为NO2,则L为NO,J为HNO3,硝酸与G反应生成M与NO,则G为Fe、H为Al2O3,M与C(浓硫酸)反应得到L(NO)与F,F与氢氧化钠反应可得Fe(OH)3,则G为Fe、H为Al2O3,M为Fe(NO3)2,F为铁盐.
(1)检验F(铁盐)溶液中是否含有少量Fe(NO3)2,亚铁离子具有还原性,可选择的试剂为:酸性KMnO4溶液,故答案为:酸性KMnO4溶液;
(2)反应⑦为Al与Fe2O3所发生的置换反应,方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,氧化铁是氧化剂,铝是还原剂,还原剂与氧化剂的物质的量之比为2:1,故答案为:2:1;
(3)某同学取F(铁盐)的溶液,酸化后加入KI、淀粉溶液,变为蓝色,说明有碘单质生成,上述变化过程相关的离子方程式:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(4)将化合物Fe2O3与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,该反应的化学方程式是:Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O,
故答案为:Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O;
(5)Al电池性能优越,Al-Ag2O电池用作水下动力电源,Al作负极,Ag2O/Ag为正极,在NaOH条件下反应得到偏铝酸钠、Ag与水,该电池反应的化学方程式为:2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,
故答案为:2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O.
点评 本题考查无机物的推断,题目难度中等,“FeS2与氧气反应、K与E的颜色、I的含量”等是推断的突破口,结合转化进行推断,需要学生熟练掌握元素化合物性质.

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案| A. | 平衡后充入氦气,平衡正向移动 | |
| B. | 以X浓度变化表示反应速率:v(X)=0.001 mol/(L•s) | |
| C. | 平衡后升高温度Y的转化率减小,则正反应为吸热反应 | |
| D. | 达到平衡时,X与Y 的浓度相等 |
| A. | CaO+H2O═Ca(OH)2 | B. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | ||
| C. | HCl+NaOH═NaCl+H2O | D. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2 |
| A. | 两个电极均为铁片,M是阴极,电解液是0.4%的NaOH溶液 | |
| B. | 两个电极均为石墨,M是阳极,电解液是0.4%的H2SO4溶液 | |
| C. | 两个电极均为石墨,M是阳极,电解液是0.4%的KOH溶液 | |
| D. | M是铁片,N是石墨,M是阴极,电解液是0.4%的KNO3溶液 |
①干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗产品.
②有关物质的部分性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S 3000C以上完全分解 |

(1)上图中尾气处理装置不够完善,请你提出改进意见:在G和H之间增加干燥装置.
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;E中反应的化学方程式:2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
(3)仪器B的名称是圆底烧瓶,C中的试剂是饱和食盐水,所起的作用是除去氯气中的氯化氢气体,粗S2Cl2产品收集在装置G中(填字母).
(4)将纯净的S2Cl2溶于足量的NaOH溶液中,发生的反应化学方程式为2S2Cl2+6NaOH═4NaCl+Na2SO3+3H2O+3S↓,
(5)为进一步检验(4)反应后溶液中大量存在的阴离子,某兴趣小组设计了如下实验:
①在所得液体中加入CS2,振荡,淡黄色固体溶解,混合液分层,该操作为萃取;
②进行分液(填操作名称),取所得上层清液继续进行实验;
③检验溶液中的阴离子(限选的试剂有:酚酞溶液、Ba(NO3)2溶液、AgNO3溶液、盐酸、稀HNO3、KMnO4溶液)
| 实验步骤 | 实验现象和结论 |
| 1.取少量溶液于试管中,滴入几滴KMnO4溶液 | KMnO4溶液颜色由紫色变绿色,说明溶液中大量存在SO32- |
| 2.另取少量溶液于试管中,加入2-3滴酚酞溶液 | 溶液颜色由无色变红,说明溶液中大量存在OH- |
| 3.另取少量溶液于试管中,加入足量1mol•L-1HNO3,再加入少量AgNO3溶液 | 仍有白色沉淀产生,说明溶液中大量存 |
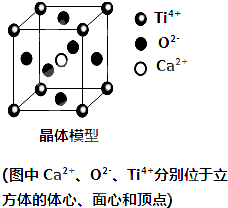
| A. | 该晶体的化学式为CaTiO3 | |
| B. | 晶体中每个Ti4+和12个Ca2+相紧邻 | |
| C. | 该晶胞中含有8个Ti4+,6个O2-和一个Ca2+ | |
| D. | 该晶体的溶沸点较低 |
| A. | 所有醛都含有醛基和烃基 | |
| B. | 羟基上氢的活性:羧酸>水>苯酚>醇 | |
| C. | 丁酸与甲酸乙酯互为同分异构体 | |
| D. | 乙二酸是最简单的二元羧酸,具有一定的还原性 |
步骤1.用电子天平准确称取样品1.5000g.
步骤2.将样品溶解并冷却后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤3.移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点.重复步骤③操作2次.
(1)根据步骤3填空:
①下列操作可导致结果偏高的是BC.
A.读取滴定终点时NaOH溶液的体积时俯视刻度线
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
②滴定时边滴边摇动锥形瓶,眼睛应观察.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
③滴定达到终点时,溶液由无色色变为粉红(或浅红)色,且半分钟内不褪色.
④配制样品溶液及滴定实验中所需的玻璃仪器除烧杯、250mL容量瓶、锥形瓶、量筒、滴定管外,还有玻璃棒、胶头滴管.(填仪器名称)
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 1.00 | 21.00 |
| 3 | 25.00 | 1.20 | 21.21 |
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖. .
.