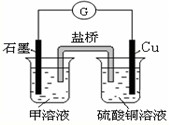
题目内容
a、b、c、d、e是同周期的五种元素,b、d、e的最高价氧化物的水化物两两皆能反应生成盐和水,c和d的气态氢化物的还原性d>c,a、b失电子后开成的简单离子的电子层结构相同,且b离子的半径大于a离子半径.则下列叙述正确的是( )
分析:b、d、e三种元素的最高价氧化物对应的水化物之间两者皆反应生成盐和水,那么其中两种最高价氧化物对应水化物应为酸和碱,而另外一种水化物既能与酸反应,又能与碱反应,必为两性氧化物,中学范围内只有Al(OH)3.同周期能与氢氧化铝反应的碱为NaOH,a、b失电子后形成的简单离子的电子层结构相同,则a、b为金属,b离子的半径大于a离子半径,则原子序数b<a,则b为钠元素;c和d的气态氢化物的还原性d>c,c、d为非金属,非金属性d<c,原子序数d<c,故c为氯元素,d为硫元素(或c为硫元素,d为磷元素);综合上述分析可知,e为铝元素,a为镁元素.
解答:解:b、d、e三种元素的最高价氧化物对应的水化物之间两者皆反应生成盐和水,那么其中两种最高价氧化物对应水化物应为酸和碱,而另外一种水化物既能与酸反应,又能与碱反应,必为两性氢氧化物,中学范围内只有Al(OH)3.同周期能与氢氧化铝反应的碱为NaOH,a、b失电子后形成的简单离子的电子层结构相同,则a、b为金属,b离子的半径大于a离子半径,则原子序数b<a,则b为钠元素;c和d的气态氢化物的还原性d>c,c、d为非金属,非金属性d<c,原子序数d<c,故c为氯元素,d为硫元素(或c为硫元素,d为磷元素);综合上述分析可知,e为铝元素,a为镁元素.故a为镁元素,b为钠元素,c为氯元素,d为硫元素(或c为硫元素,d为磷元素),e为铝元素.
A、由上述分析可知,c为氯元素或硫元素,故A错误;
B、a为镁元素、e为铝元素,形成的阳离子电子层排布相同,核电荷数越大,离子半径越小,故离子半径a>e,d为硫元素或磷元素,形成阴离子,比a、e离子多1个电子层,最外层电子数相同,所以离子半径d离子最大,即d>a>e,故B错误;
C、a为镁元素,b为钠元素,c为氯元素,d为硫元素(或c为硫元素,d为磷元素),e为铝元素,原子序数有小到大的顺序为b、a、e、d、c,故C错误;
D、a为镁元素,b为钠元素,c为氯元素,d为硫元素(或c为硫元素,d为磷元素),e为铝元素,原子序数有小到大的顺序为b、a、e、d、c,故D正确.
故选D.
A、由上述分析可知,c为氯元素或硫元素,故A错误;
B、a为镁元素、e为铝元素,形成的阳离子电子层排布相同,核电荷数越大,离子半径越小,故离子半径a>e,d为硫元素或磷元素,形成阴离子,比a、e离子多1个电子层,最外层电子数相同,所以离子半径d离子最大,即d>a>e,故B错误;
C、a为镁元素,b为钠元素,c为氯元素,d为硫元素(或c为硫元素,d为磷元素),e为铝元素,原子序数有小到大的顺序为b、a、e、d、c,故C错误;
D、a为镁元素,b为钠元素,c为氯元素,d为硫元素(或c为硫元素,d为磷元素),e为铝元素,原子序数有小到大的顺序为b、a、e、d、c,故D正确.
故选D.
点评:本题考查性质结构与物质关系,难度较大,推断元素是关键,突破口为三种元素的最高价氧化物对应的水化物之间两者皆反应生成盐和水,根据元素化合物知识猜测推断.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水.下列说法不正确的是( )
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |
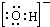
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热