题目内容
2008年9月我国“神七”发射升空,中国航天员实现首次太空行走.运载火箭的原料用肼(N2H4)作为发动机的燃料,NO2为氧化剂,反应生成氮气和水蒸气.已知: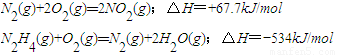
下列判断正确的是( )
A..所有物质与氧气发生的化学反应都是放热反应
B..N2H4的燃烧热为534kJ/mol
C.肼与NO2反应的热化学方程 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=-1135.7kJ/mol
D..3.2g肼完全反应转移的电子数为0.6mol
【答案】分析:A、由信息可知氮气与氧气反应是吸热反应.
B、燃烧热指在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,单质或化合物必须是完全燃烧,如反应物中C→CO2,H→H2O(液),S→SO2(气)等.
C、根据盖斯定律由已知的热化学方程式构造目标热化学方程式.
D、3.2g肼的物质的量为0.1mol,氮元素由-2价升高为0价,据此计算.
解答:解:A、由信息可知氮气与氧气反应是吸热反应,物质与氧气发生的化学反应不都是放热反应,故A错误;
B、信息中肼燃烧生成的水为气态,氮元素不是氧化物形式,故N2H4的燃烧热不是534kJ/mol,故B错误;
C、已知①:N2(g)+2O2(g)=2NO2(g)△H=+67.7 kJ/mol ②:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ/mol
由盖斯定律②×2-①得:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=2×(-534 kJ/mol)-67.7 kJ/mol=-1135.7kJ/mol,故C正确;
D、3.2g肼的物质的量为0.1mol,氮元素由-2价升高为0价,3.2g肼完全反应转移的电子数为0.1mol×4=0.4mol,故D错误.
故选:C.
点评:考查燃烧热、热化学方程式书写与反应热计算、氧化还原反应等,难度中等,注意把握燃烧热与中和热的概念,理解盖斯定律.
B、燃烧热指在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,单质或化合物必须是完全燃烧,如反应物中C→CO2,H→H2O(液),S→SO2(气)等.
C、根据盖斯定律由已知的热化学方程式构造目标热化学方程式.
D、3.2g肼的物质的量为0.1mol,氮元素由-2价升高为0价,据此计算.
解答:解:A、由信息可知氮气与氧气反应是吸热反应,物质与氧气发生的化学反应不都是放热反应,故A错误;
B、信息中肼燃烧生成的水为气态,氮元素不是氧化物形式,故N2H4的燃烧热不是534kJ/mol,故B错误;
C、已知①:N2(g)+2O2(g)=2NO2(g)△H=+67.7 kJ/mol ②:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ/mol
由盖斯定律②×2-①得:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=2×(-534 kJ/mol)-67.7 kJ/mol=-1135.7kJ/mol,故C正确;
D、3.2g肼的物质的量为0.1mol,氮元素由-2价升高为0价,3.2g肼完全反应转移的电子数为0.1mol×4=0.4mol,故D错误.
故选:C.
点评:考查燃烧热、热化学方程式书写与反应热计算、氧化还原反应等,难度中等,注意把握燃烧热与中和热的概念,理解盖斯定律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目