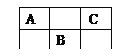
题目内容
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐,易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠与硫酸反应的气体产物成分及NaNO2性质进行如下探究:

已知:①NO+NO2+2OH-=2NO2-+H2O;
②气体液化的温度:NO2:21℃,NO:152℃。
(1)仪器a的名称是_____________________。
(2)若要验证A中反应生成的气体产物成分且又不能污染环境,仪器的连接顺序为(用字母序号从左→右表示):A、C、______、______、__________。
(3)B中NaOH溶液的作用是_____________________________________。
(4)反应前打开弹簧夹,通入一段时间氮气,其目的是_______________________;关闭弹簧夹,打开分液漏斗活寒,滴入70%硫酸后,A中产生红棕色气体。
(5)①确认A反应产生的气体中含有NO的现象是:_________________________。
②A中反应的化学反应方程式为________________________________。
(6)利用所提供的试剂(NaNO2溶液、KMnO4溶液、KI溶液、稀硫酸、淀粉溶液)设计实验,证明酸性条件下NaNO2具有氧化性________________________________。
【答案】 分液漏斗 E D B 吸收NO、NO2等尾气,防止其污染空气 排尽空气(氧气)防止对产物成分NO的验证 D中通入氧气后,气体由无色变为红棕色 2NaNO2+H2SO4 =Na2SO4+NO2↑+NO↑+H2O 取少量碘化钾溶液并滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加适量NaNO2溶液,溶液变蓝,证明NaNO2具有氧化性
【解析】(1)根据仪器构造可知仪器a的名称是分液漏斗。(2)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO,所以装置的连接顺序为A→C→E→D→B;(3)氮氧化合物有毒,因此B中NaOH溶液的作用是吸收NO、NO2等尾气,防止其污染空气。(4)NO很容易被氧气氧化,装置中有空气,无法检验有NO生成,所以通氮气的目的是排尽整个装置中的空气,防止产生的NO被氧化生成NO2;(5)①D中无色气体变成红色,说明含有NO气体,因此确认A反应产生的气体中含有NO的现象是D中通入氧气后,气体由无色变为红棕色;②通过以上分析知,该反应中生成二氧化氮、一氧化氮,同时还有硫酸钠、水生成,所以反应方程式为2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O。(6)亚硝酸钠能把碘化钾氧化为单质碘,碘遇淀粉显蓝色,则证明酸性条件下NaNO2具有氧化性的实验操作是取少量碘化钾溶液并滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加适量NaNO2溶液,溶液变蓝,证明NaNO2具有氧化性。

 字词句段篇系列答案
字词句段篇系列答案【题目】请同学们根据官能团的不同对下列有机物进行分类(填序号).
①CH3CH2OH② ![]() ③CH3CH2Br④
③CH3CH2Br④ ![]() ⑤
⑤ ![]() ⑥
⑥ ![]() ⑦
⑦ ![]() ⑧
⑧ ![]() ⑨
⑨ ![]() ⑩
⑩ 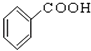
(1)卤代烃:;
(2)酯:;
(3)醇:;
(4)醛:;
(5)羧酸 .