题目内容
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。
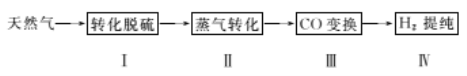
请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。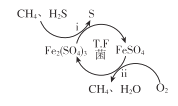
(1)过程i中H2S发生了 ___(选填“氧化”或“还原”)反应。
(2)过程ⅱ的离子方程式是____。
(3)已知:①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeS04溶液中Fe2+的氧化速率如下表。
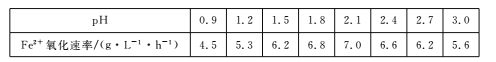
请结合以上信息,判断工业脱硫应选择的最佳pH范围,并说明原因:____。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
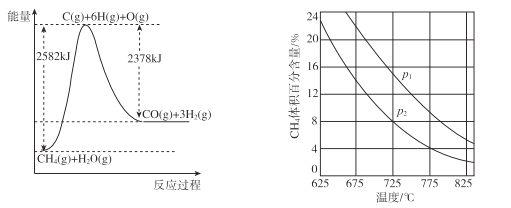
(4)①该过程的热化学方程式是____。
②比较压强P1和p2的大小关系:p1 __ p2(选填“>”“<”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程示意图如下。
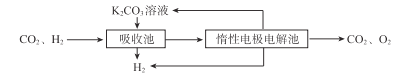
(5)①吸收池中发生反应的离子方程式是 ___。
②结合电极反应式,简述K2CO3溶液的再生原理:____。
【答案】 氧化 4Fe2++O2+4H+ ![]() 4Fe3++2H2O 1.5≤pH<1.9;当pH大于1.9时,Fe3+开始沉淀,导致Fe3+和Fe2+浓度均下降,会降低反应速率。当pH小于1.5时,T.F菌活性较低,反应速率减慢 CH4(g)+H2O
4Fe3++2H2O 1.5≤pH<1.9;当pH大于1.9时,Fe3+开始沉淀,导致Fe3+和Fe2+浓度均下降,会降低反应速率。当pH小于1.5时,T.F菌活性较低,反应速率减慢 CH4(g)+H2O![]() CO(g)+3H2(g) △H=+204kJ/mol > CO2+H2O+CO32-=2HCO3- 极反应:2H2O+2e-=H2+2OH-,OH-+HCO3-=CO32-+H2O,使K2CO3溶液得以再生。
CO(g)+3H2(g) △H=+204kJ/mol > CO2+H2O+CO32-=2HCO3- 极反应:2H2O+2e-=H2+2OH-,OH-+HCO3-=CO32-+H2O,使K2CO3溶液得以再生。
【解析】(1)考察氧化还原的基本概念判断。由图可知,过程i中H2S变成了S,S元素由-2价变成0价,化合价升高发生了氧化反应。
(2)考察陌生氧化还原离子方程式的书写及配平方法,由图可知过程ii是FeSO4和氧气反应生成Fe2(SO4)3,注意题干中说脱硫过程在酸性环境中。
(3)考察题目分析综合能力,由①可知Fe3+在pH=1.9时开始沉淀会导致Fe3+浓度降低,则Fe2+和Fe3+浓度均会降低,速率降低。故pH应该小于1.9。由图②可知pH在1.5的时候Fe2+的氧化速率较快,故pH的取值范围是1.5≤pH<1.9。
(4)①考察热化学反应方程式的书写和图像问题,注意物质的聚集状态,故△H=+204kJ/mol。②考察平衡移动,其它条件不变,压强越大,平衡逆向移动,则CH4的体积分数增大,则p1>p2。
(5)①考察离子方程式的书写。由图示已知吸收池用的是K2CO3溶液,吸收CO2,则离子方程式为CO32-+CO2+H2O=2HCO3-。②考察电解池电极反应方程。已知惰性电极电解池中的电解液是KHCO3,阴极水放电生成氢气,阴极附近c(OH-)增大,氢氧根和碳酸氢根反应生成碳酸根OH-+HCO-=CO2-+H2O,K+向阴极迁移,使K2CO3溶液得以再生(溶液电中性)。

【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
浓度c/mol/L | 0.1 | 0.1 | 0.1 | 0.1 |
溶液 | 氨水 | CH3COONa溶液 | 醋酸 | 盐酸 |
A.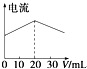 在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如图
在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如图
B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO﹣)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
D.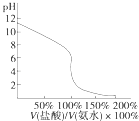 用④滴定①,滴定曲线如图,可用酚酞作指示剂
用④滴定①,滴定曲线如图,可用酚酞作指示剂