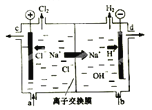
题目内容
【题目】燃料电池是将乙醇通入负极,O2通入正极而发生电池反应的,其能量转换率高.
(1)若电解质溶液为KOH,其正极反应为 ,负极反应为 ;
(2)若电解质溶液为硫酸,其正极反应为 ,负极反应为 ;
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=0.3molL﹣1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体.此时燃料电池中消耗H2的质量是 ,O2的质量是 .
【答案】(1)O2+4e﹣+2H2O=4OH﹣;H2+2OH﹣﹣2e﹣=2H2O;
(2)O2+4H++4e﹣=2H2O;H2﹣2e﹣=2H+;
(3)0.03g;0.24g.
【解析】
试题分析:(1)若电解质溶液为KOH溶液时,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子和水生成氢氧根离子;
(2)酸性条件下,正极上氧气得电子和氢离子反应生成水,负极上氢气失电子生成氢离子;
(3)用氢氧燃料电池电解NaCl和CuSO4组成的混合溶液时,阴极上先铜离子放电,后氢离子放电,根据转移电子数相等计算氢氧燃料电池外电路中转移电子数,根据氢气和转移电子之间的关系式计算氢气、氧气的质量.
解:(1)若电解质溶液为KOH溶液时,正极上氧气得电子和水生成氢氧根离子,电极反应式为O2+4e﹣+2H2O=4OH﹣,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2+2OH﹣﹣2e﹣=2H2O,
故答案为:O2+4e﹣+2H2O=4OH﹣;H2+2OH﹣﹣2e﹣=2H2O;
(2)酸性条件下,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e﹣+4H+=2H2O,负极上氢气失电子生成氢离子,电极反应式为H2﹣2e﹣=2H+,
故答案为:O2+4H++4e﹣=2H2O;H2﹣2e﹣=2H+;
(3)用氢氧燃料电池电解NaCl和CuSO4组成的混合溶液时,阴极上先铜离子放电,后氢离子放电,c(Na+)=3c(Cu2+)=0.3molL﹣1,即混合溶液中铜离子的浓度是0.1mol/L,100mL混合溶液中n(Cu2+)=0.1mol/L×0.1L=0.01mol,
析出0.01mol铜需要转移0.02mol电子,阴极上生成氢气需要转移电子的物质的量=![]() mol×2=0.01mol,所以电解时转移的总电子物质的量为0.03mol,串联电路中转移电子数相等,所以氢氧燃料电池外电路中转移电子数为0.03NA,则消耗氢气的质量=0.015×2g/mol=0.03g,氧气的质量为0.03mol×
mol×2=0.01mol,所以电解时转移的总电子物质的量为0.03mol,串联电路中转移电子数相等,所以氢氧燃料电池外电路中转移电子数为0.03NA,则消耗氢气的质量=0.015×2g/mol=0.03g,氧气的质量为0.03mol×![]() ×32g/mol=0.24g;
×32g/mol=0.24g;
故答案为:0.03g;0.24g.

【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
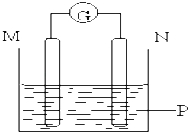
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D