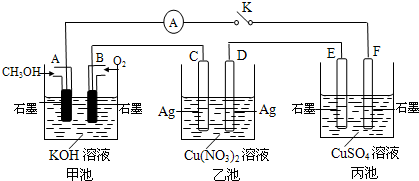
题目内容
下列是某兴趣小组研究浓硫酸的氧化性的结论并进行了实验验证:
①一般认为1:1的硫酸浓度大于60%,就具有一定的氧化性,越浓氧化性越强,60%以下的H2SO4氧化性就不怎么强了。
②温度也影响氧化性,如铜放于冷的浓硫酸中反应不明显,如果加热就可以观察到明显现象。
③98%的浓硫酸物质的量浓度为18.4mol?L-1,密度为1.84g?cm-3据以上信息回答:
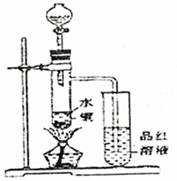
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓硫酸10―15滴(约0.5mL),加热至沸腾,该试管中液体是否有明显变化 _____。试用数据解释原因_________________________________。
(2)甲同学再用分液漏斗加浓硫酸10mL再加热至沸腾,现象是_____________________
__________________________。
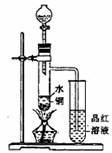
(3)乙同学利用所示装置直接从分液漏斗中加浓硫酸10mL与铜片反应。所观察到与甲不同的现象是______ ___________________原因是___________ _________________。为了最终看到与甲类似的现象,乙同学需进行的操作是_______________________________________。
(4)乙同学进行加热,还在带支管的试管中观察到有黑色物质出现,大胆假设此物质是_______________。
(1)否 硫酸溶质质量分数为23%<60%,其氧化性不突出所以无明显现象
(2)铜片慢慢溶解,带支管的试管中溶液渐成蓝色小试管中品红褪色。
(3)现象是: 液体无色或浅蓝色,有白色固体在试管底部析出。
原因: 98%浓H2SO4有吸水性只剩无水CuSO4。
待支管的试管冷却后沿烧杯壁缓缓加入到水中,并不断用玻璃棒搅拌。
(4)Cu2S或CuS或Cu2S与CuS混合物