题目内容
(12分)某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
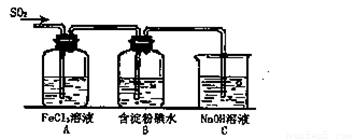
(1)SO2气体与Fe3+反应的主要产物是__ __ 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是 。
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。
(1)SO42-、Fe2+(2分) (2)BD (2分)
(3)吸收多余的SO2,防止污染空气(1分), (4)0.25 (2分)
(5)方案①(1分)、SO2的水溶液也能使KMnO4溶液褪色(1分)
(6)B中蓝色溶液变无色(1分)、I2+SO2+2H2O=2I-+SO42-+4H+ (2分)
【解析】
试题分析:(1)SO2具有还原性,铁离子具有氧化性,二者发生氧化还原反应,即2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,所以SO2气体还原Fe3+反应的产物是Fe2+,SO42-。
(2)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错;B、浓硫酸虽具有强氧化性,但不能氧化亚硫酸钠,能和亚硫酸钠反应生成SO2,故B正确;C、固体硫在纯氧中燃烧,操作不容易控制,故C错;D、铜与浓硫酸反应的离子方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,所以可以制备SO2,故D正确,因此选BD。
CuSO4+SO2↑+2H2O,所以可以制备SO2,故D正确,因此选BD。
(3)二氧化硫是酸性氧化物具有刺激性气味,属于大气污染物,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液吸收二氧化硫,防止污染空气。
(4)280mL SO2气体(已折算为标态)物质的量=0.28L÷22.4L/mol=0.0125mol,SO2是酸性氧化物,进入C装置中发生反应为SO2+NaOH=NaHSO3,则C中消耗氢氧化钠物质的量为0.0125mol,50mL NaOH溶液的浓度至少=0.0125mol÷0.05L=0.25mol/L。
(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,而Fe2+也使高锰酸钾溶液褪色,因此方案①不合理。
(6)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,据此能表明I—的还原性弱于SO2的还原性,反应的离子方程式为I2+SO2+2H2O=2HI+H2SO4。
考点:考查SO2制备以及性质的实验探究、实验方案设计与评价、氧化还原反应的应用等

 名校课堂系列答案
名校课堂系列答案

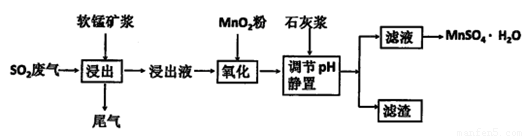
 生产流程,其流程示意图如下:
生产流程,其流程示意图如下: