题目内容
(1)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+
O2(g)═Cu2O(s)△H=-169kJ?mol-1,
C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1,
2Cu(s)+O2(g)═CuO(s)△H=-314kJ?mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
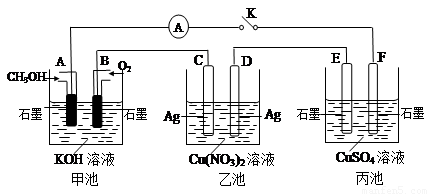
(2)某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转.
请回答下列问题:
(1)甲池为
(2)丙池中F电极为
(3)当池中C极质量减轻10.8g时,甲池中B电极理论上消耗O2的体积为
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3.
2Cu(s)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
2Cu(s)+O2(g)═CuO(s)△H=-314kJ?mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
C(s)+2CuO(s)=CuO(s)+CO(g)△H=+34.5kJ?mol-1
C(s)+2CuO(s)=CuO(s)+CO(g)△H=+34.5kJ?mol-1
.(2)某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转.

请回答下列问题:
(1)甲池为
原电池
原电池
(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O
CH3OH+8OH--6e-=CO32-+6H2O
.(2)丙池中F电极为
阴极
阴极
(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为2CuSO4+2H2O
2H2SO4+2Cu+O2↑
| ||
2CuSO4+2H2O
2H2SO4+2Cu+O2↑
.
| ||
(3)当池中C极质量减轻10.8g时,甲池中B电极理论上消耗O2的体积为
560
560
mL(标准状况).(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是
A
A
(填选项字母).A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3.
分析:(1)根据盖斯定律结合热化学方程式的书写方法来书写;
(2)①根据燃料电池的工作原理知识负极上是燃料上发生失电子的氧化反应来回答;
②根据电解池阴极阳极的判断方法以及电解池的工作原理来回答;
③根据电子守恒来计算回答;
④根据溶液复原的方法:出什么加什么来回答.
(2)①根据燃料电池的工作原理知识负极上是燃料上发生失电子的氧化反应来回答;
②根据电解池阴极阳极的判断方法以及电解池的工作原理来回答;
③根据电子守恒来计算回答;
④根据溶液复原的方法:出什么加什么来回答.
解答:解:(1)已知:①2Cu(s)+
O2(g)═Cu2O(s)△H=-169kJ?mol-1,
②C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1,
③2Cu(s)+O2(g)═CuO(s)△H=-314kJ?mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu(s)+CO(g),
该反应可以是②-③-
×①,反应的焓变是-110.5kJ?mol-1-(-314kJ?mol-1)-
×(-169kJ?mol-1)=34.5kJ?mol-1,
故答案为:C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ?mol-1;
(2)①甲池是燃料电池,属于原电池,在该燃料电池中,负极上是甲醇发生失电子的氧化反应,在碱性环境下,CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:原电池;CH3OH+8OH--6e-=CO32-+6H2O;
②甲池中,通入甲醇的电极是负极,通入氧气的电极是正极,所以F是阴极,E是阳极,D是阴极,C是阳极,电解硫酸铜溶液的电极反应式为:2CuSO4+2H2O
2H2SO4+2Cu+O2↑,故答案为:阴极;2CuSO4+2H2O
2H2SO4+2Cu+O2↑;
③C极上的电极反应为:Ag-e-=Ag+,B电极上的电极反应为:O2+2H2O+4e-=4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.25mol,体积为0.25mol×22.4L/mol=0.56L=560mL,故答案为:560;
④乙池子电解硝酸铜,用活泼电极金属银为阳极,所以在阴极上是铜离子得电子生成金属铜的反应,溶液中减少了Cu元素的质量,所以要让电解质复原,需要加入金属铜,故选A.
| 1 |
| 2 |
②C(s)+
| 1 |
| 2 |
③2Cu(s)+O2(g)═CuO(s)△H=-314kJ?mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu(s)+CO(g),
该反应可以是②-③-
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ?mol-1;
(2)①甲池是燃料电池,属于原电池,在该燃料电池中,负极上是甲醇发生失电子的氧化反应,在碱性环境下,CH3OH+8OH--6e-=CO32-+6H2O,
故答案为:原电池;CH3OH+8OH--6e-=CO32-+6H2O;
②甲池中,通入甲醇的电极是负极,通入氧气的电极是正极,所以F是阴极,E是阳极,D是阴极,C是阳极,电解硫酸铜溶液的电极反应式为:2CuSO4+2H2O
| ||
| ||
③C极上的电极反应为:Ag-e-=Ag+,B电极上的电极反应为:O2+2H2O+4e-=4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.25mol,体积为0.25mol×22.4L/mol=0.56L=560mL,故答案为:560;
④乙池子电解硝酸铜,用活泼电极金属银为阳极,所以在阴极上是铜离子得电子生成金属铜的反应,溶液中减少了Cu元素的质量,所以要让电解质复原,需要加入金属铜,故选A.
点评:本题是一道热化学和电化学结合的综合考查题,要求学生主义知识的梳理和归纳是解题的关键,难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
(1) 纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
2Cu(s)+![]() O2(g) === Cu2O(s) ΔH=-169kJ·mol-1,
O2(g) === Cu2O(s) ΔH=-169kJ·mol-1,
C(s)+ ![]() O2(g) === CO(g) ΔH=-110.5kJ·mol-1,
O2(g) === CO(g) ΔH=-110.5kJ·mol-1,
2Cu(s)+ O2(g)=== CuO(s) ΔH=-314kJ·mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
。
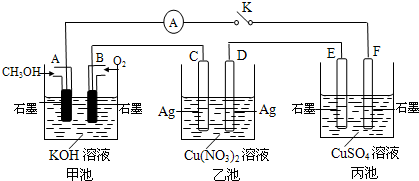
(2)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
 |
请回答下列问题:
(1)甲池为 (填“原电池”、“电解池”或 “电镀池”),A电极的电极反应式为 。
(2)丙池中F电极为 (填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为
。
(3)当池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是 (填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
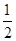 O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,
O2(g) ="==" Cu2O(s) ΔH=-169kJ·mol-1,
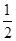 O2(g) ="==" Cu2O(s)
ΔH=-169kJ·mol-1,
O2(g) ="==" Cu2O(s)
ΔH=-169kJ·mol-1,