题目内容
【题目】已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2,32.5克的锌与50 mL 18.4 mol/L浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体VL。将反应后的溶液稀释到500mL,测得溶液中氢离子的浓度为0.08 mol/L。
(1)反应过程中消耗的H2SO4的物质的量是________。
(2)气体的成分是______,V为______。
(3)反应过程中转移的电子的物质的量是________。
(4)另取相同浓硫酸,向其中改加铁粉,若逐渐加入a克铁粉,同时加热,最终数据均同上,则a=_____。
【答案】0.9 mol 二氧化硫和氢气 V=11.2 1mol 28
【解析】
(1)原硫酸的物质的量=50mL×18.4mol/L=0.92mol;
反应后,氢离子浓度为0.08mol/L,则硫酸的浓度为0.04mol/L;
反应后硫酸的物质的量为0.04mol/L×500mL=0.02mol;
则反应消耗的硫酸的物质的量为0.92mol-0.02mol=0.9mol;
(2)假设生成二氧化硫的物质的量为x,生成氢气的物质的量为y,根据化学方程式Zn+2H2SO4=ZnSO4+SO2↑+H2O,Zn+H2SO4=ZnSO4+H2↑;可得
![]() ,解得
,解得![]() ;
;
则生成气体的体积为(0.4+0.1)×22.4=11.2L;
(3)反应共消耗Zn的物质的量为32.5÷65=0.5mol,反应中Zn被氧化为Zn2+,故反应过程中转移的电子的物质的量是1mol;
(4)另取相同浓硫酸,向其中改加铁粉,虽然浓硫酸的氧化性很强,开始会将Fe氧化到+3价,但是随着浓度变稀,Fe3+会和Fe反应生成Fe2+,因此溶液中最终均为+2价的亚铁离子,与溶液中均为+2的锌离子相似,则最终数据相同,加入Fe的物质的量与Zn的物质的量相同,均为0.5mol,其质量为0.5mol×56g/mol=28g。

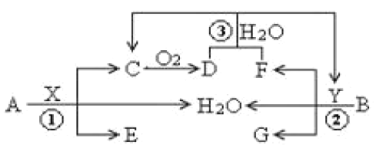
【题目】硅在无机非金属材料中,扮演着主要角色,请利用相关知识回答下列问题:
(1)硅有非常重要的用途,请写出其中的一种:_________________________________。
(2)古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是________。
A.可用氧化物形式表示为BaO·CuO·2SiO2
B.性质稳定,不易脱色
C.x等于6
D.易溶解于强酸和强碱
(3)工业上提纯硅有多种路线,其中一种工艺流程示意图如下:

①在电弧炉中发生的反应需要在高温条件进行,写出该反应化学方程式:________________。
②SiCl4极易水解,在空气中生成烟尘和白雾,推测书写其水解的化学方程式为____________________。
③在流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等,有关物质的沸点数据如下表,分离SiCl4和其他杂质的方法为________。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |