题目内容
【题目】100℃时,向容积为2L的密闭容器中充入一定量的X气体和Y气体,发生如下反应:
X(g)+2Y(g) ![]() Z(g);反应过程中测定的部分数据见下表:
Z(g);反应过程中测定的部分数据见下表:
反应时间/min | n(X)/mol | n(Y)/ mol |
0 | 2.00 | 2.40 |
10 | 1.00 | |
30 | 0.40 |
下列说法正确的是( )
A.前10 min内反应的平均速率为v(Z)=0.10 mol·L-1·min-1
B.温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应
C.若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则c(X)<1mol/L
D.保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,到达平衡后,X转化率增大
【答案】C,D
【解析】解:A、由表中时间可知,1 0min内X的物质的量变化量为2mol-1mol=1mol,由方程式可知Z的物质的量变化量为1mol,故v= ![]() =0.05molL-1 min-1 , 错误;B、
=0.05molL-1 min-1 , 错误;B、
X(g) | Y(g) | Z(g) | |
开始(mol/L) | 1.0 | 1.2 | 0 |
变化(mol/L) | 0.5 | 1.0 | 0.5 |
平衡(mol/L) | 0.5 | 0.2 | 0.5 |
故该温度下平衡常数K=0.5/(0.5×0.22)=25升高到200℃时,上述反应平衡常数为20,所以升高温度,平衡向逆反应进行,故正反应为放热反应,错误。C.缩小一半体积,浓度增大一倍,c(X)=1mol/L;但压强增大,平衡正向移动,反应物浓度降低,故c(X)<1mol/L;,正确,D.按起始比例再通入反应物,压强增大,平衡正向移动,反应物的转化率增大正确。
故选CD。
【考点精析】认真审题,首先需要了解反应热和焓变(在化学反应中放出或吸收的热量,通常叫反应热),还要掌握化学平衡移动原理以及影响因素(影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动)的相关知识才是答题的关键.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案【题目】用如图所示装置检验乙烯时不需要除杂的是( )
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
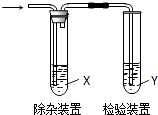
A.A
B.B
C.C
D.D