题目内容
【题目】如下图表示反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
2SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
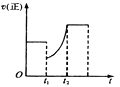
A. t1时增加了SO2和O2的浓度,平衡向正反应方向移动
B. t1时降低了温度,平衡向正反应方向移动
C. t1时减小了压强,平衡向逆反应方向移动
D. t1时减小了SO2的浓度,又增加了SO3的浓度,导致平衡向逆反应方向移动
【答案】D
【解析】
A、增加反应物浓度,速率加快,不符合;
B、降低温度正逆反应速率均减小,平衡正向移动,最后平衡速率小于原速率;
C、减小压强正逆反应速率均减小,平衡逆向移动,最后平衡速率小于原速率;
D、减小反应物浓度,速率减小,增加生成物浓度,平衡逆向移动,正确。

 走进文言文系列答案
走进文言文系列答案【题目】(1)工业上氨气的催化氧化反应的化学方程式_____________
(2)偏铝酸钠溶液中通入过量二氧化碳的离子方程式_____________;
(3)根据部分键能数据,以及热化学方程式CH4(g)+4F2(g) = CF4(g)+4HF(g)
ΔH =-1940 kJ·mol-1,计算H—F键的键能为______________。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | ? | 155 |
(4)0.1mol的氯气和焦炭、TiO2固体完全反应,生成TiCl4液体和一种还原性的气体,放出热量4.28kJ,写出该反应的热化学方程式_________________。
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)四种元素简单离子的半径由大到小为_______(用离子符号表达)。
(2)W的最简单氢化物的电子式为______。
(3)Y单质与Fe2O3反应能放出大量的热,常用于焊接钢轨,该反应化学方程式为:________。Y的最高价氧化物与Z的气态氢化物的水溶液反应的离子方程式:__________。
(4)向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为_________。