题目内容
【题目】高炉炼铁过程中发生的主要反应为
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH____(填“>”“<”或“=”)0。
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=____、CO的平衡转化率=____。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是____。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
【答案】K=![]() < 0.006 mol·(L·min)-1 60% C
< 0.006 mol·(L·min)-1 60% C
【解析】
(1)平衡常数表达式中不能用固体或纯液体表示,故K=![]() ;由表中数据可知,随着温度升高,平衡常数减小,表明平衡向逆反应方向移动,即正反应为放热反应,故ΔH<0。
;由表中数据可知,随着温度升高,平衡常数减小,表明平衡向逆反应方向移动,即正反应为放热反应,故ΔH<0。
(2)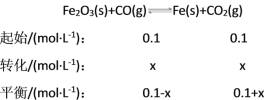
K==4.0,x=0.06,v(CO2)==0.006 mol·(L·min)-1,CO转化率=![]() ×100%=60%。
×100%=60%。
(3)A、B项中,增加或减少固体的量不会影响化学平衡移动,故不可以;
C项,移出部分CO2,可以增大CO转化率;
D项,提高反应温度,平衡向逆反应方向移动,CO转化率减小;
E项,减小容器的容积,即加压,平衡不移动,CO的转化率不变;
F项,催化剂不影响化学平衡移动,故不影响CO转化率。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目