题目内容
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
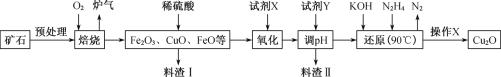
(1) “焙烧”时,提高反应速率的措施有____________(写一条)。
(2)炉气中的有害气体成分是__________。
(3)若试剂X是H2O2溶液,写出相应反应的离子方程式:_________。
【答案】适当升温或粉碎硫化铜矿石、充分搅拌等 SO2 2Fe2++2H++H2O2![]() 2Fe3++2H2O
2Fe3++2H2O
【解析】
根据流程:硫化铜矿石(含CuFeS2、Cu2S等)在氧气中焙烧,得到Fe2O3、CuO、FeO等,加入稀硫酸除去不溶物,得到含有Fe2+、Cu2+、Fe3+的溶液,加入试剂X氧化Fe2+,若试剂X是H2O2溶液,反应为:2Fe2++H2O2+2H+=2Fe3++2H2O,氧气或空气也可以达到此目的,利于降低生产成本,加入试剂Y条件pH范围3.7≤pH<4.8,沉淀Fe3+,滤渣II为氢氧化铁,向滤液加入N2H4、KOH发生反应:4CuSO4+N2H4+8KOH![]() 2Cu2O↓+N2↑+4K2SO4+6H2O,通过过滤、洗涤、烘干得到产品,据此分析作答。
2Cu2O↓+N2↑+4K2SO4+6H2O,通过过滤、洗涤、烘干得到产品,据此分析作答。
(1)为了提高反应速率,可以适当升温或粉碎硫化铜矿石、充分搅拌等;
(2)金属硫化物焙烧时均转化为金属氧化物与二氧化硫,故炉气中的有害气体成分是SO2;
(3) 酸性条件下,H2O2将Fe2+氧化为Fe3+,本身被还原为H2O,方程式为2Fe2++2H++H2O2=2Fe3++2H2O;

【题目】高炉炼铁过程中发生的主要反应为
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH____(填“>”“<”或“=”)0。
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=____、CO的平衡转化率=____。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是____。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂