题目内容
【题目】结合元素周期表,完成下列问题。
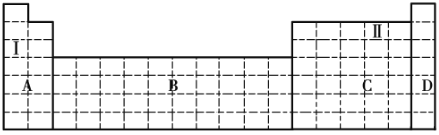
(1)在元素周期表中全部是金属元素的区域为____________(填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为__________________。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置__________。
②甲、乙两元素中,金属性较强的是__________(填元素名称),可以验证该结论的实验是_______________(填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
【答案】b Na2O、Na2O2  镁 bc
镁 bc
【解析】
根据元素周期表的结构,同一周期的元素,由前到后,元素的金属性逐渐减弱,非金属性逐渐减弱;同一主族的元素,从大到小,元素的金属性逐渐增强,非金属性逐渐减弱,结合元素及化合物的性质分析解答。
(1)A区元素为S区元素,有金属元素如Na等,也有非金属元素,如H;B区元素为过渡元素,全部为金属元素;C区为金属元素、非金属元素共同存在的区域,金属元素如Al等,非金属元素如F、Cl、N等元素,D区元素为0族元素(或稀有气体元素),全部为非金属元素,所以在元素周期表中全部是金属元素的区域为B区,合理选项是b。
(2)Ⅰ表示的元素是Na,Ⅱ表示的元素是O,二者形成的化合物有Na2O、Na2O2;
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,则甲是Al元素;乙元素原子核外第三层与第一层上的电子数相等,则乙核外电子排布为2、8、2,所以乙为![]() 元素;
元素;
①Mg核外电子排布为2、8、2,在元素周期表的位置位于第三周期、第IIA;Al核外电子排布为2、8、3,因此Al在周期表的位置位于第三周期第IIIA族,填写在元素周期表为: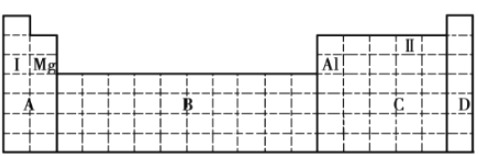 ;
;
②Mg、Al是同一周期的元素,根据元素周期律,同一周期的元素,随着原子序数的递增,元素的金属性逐渐减弱,故Mg的金属性比Al强,故甲、乙两元素中,金属性较强的是镁元素;
a.Mg、Al在空气中放置,金属表面会被氧化产生致密的氧化物MgO、Al2O3薄膜,MgO、Al2O3不能溶于水,也不能发生反应,因此不能与热水发生反应,所以不能比较两种金属活动性的强弱,a错误;
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应,金属活动性越强,其单质活动性越强,因此可以证明金属活动性Mg>Al,b正确;
c.Mg粉与热水反应产生Mg(OH)2和H2,Mg(OH)2使酚酞溶液变为浅红色,而Al与热水不能反应,所以可以证明金属活动性强弱关系Mg>Al,c正确;
d.这两种元素都是金属,不能形成气态氢化物,因此不能通过比较这两种元素的气态氢化物的稳定性判断元素金属性的强弱,d错误;
故合理选项是bc。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
A | 第3周期ⅣA族 |
B | 族序数是周期数的3倍 |
C | 原子序数是11 |
D | D3+与Ne的电子数相同 |
(1)A、B的元素符号分别为__、__,C、D的元素名称分别为__、__。
(2)写出B、C的常见单质在加热时的反应方程式:__。
(3)从原子结构的角度分析,A原子与B原子的__相同,C原子与D原子的__相同。
【题目】甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。甲醇的合成方法是:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
回答下列问题:
(1)甲醇的燃烧热为__kJ·mol-1。
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为__。
(3)若反应在密闭恒容绝热容器中进行,反应(iv)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.1kJ·mol-1对合成甲醇反应中CO的转化率的影响是(_________)
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如下表:
浓度/mol·L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
0 | 0.8 | 1.6 | 0 |
2 | 0.6 | x | 0.2 |
4 | 0.3 | 0.6 | 0.5 |
6 | 0.3 | 0.6 | 0.5 |
①x=__。
②前2min内H2的平均反应速率为v(H2)=__。该温度下,反应(ⅰ)的平衡常数K=__。(保留1位小数)
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是(_________)
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)如图是温度、压强与反应(ⅰ)中CO转化率的关系:
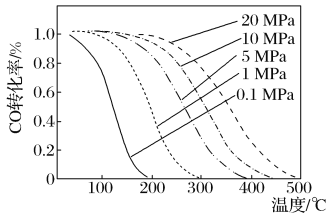
由图像可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是__。