��Ŀ����
����Ŀ�������£���100 mL 0.01 mol��L��1 HA��Һ����μ���0.02 mol��L��1 MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���(����仯���Բ���)���ش��������⣺
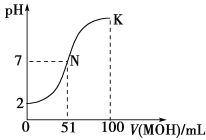
(1)��ͼ����Ϣ��֪HAΪ________��(�ǿ��������)��������_______________��
(2)MAϡ��Һ��pH��a����a________7(�>����<������)�������ӷ���ʽ��ʾ��ԭ��Ϊ_______________����ʱ����Һ����ˮ�������c(OH��)��________��
(3)��д��K������Ӧ����Һ������Ũ�ȵĴ�С��ϵ��________��
(4)K���Ӧ����Һ�У�c(M��)��c(MOH)________2c(A��)(�>����<������)������ʱ��Һ��pH��10����c(MOH)��c(OH��)��________mol��L��1(�ô���ʽ��ʾ)��
���𰸡�(1)ǿ 0.01 mol��L��1 HA��Һ��pHΪ2��˵��HA��ȫ����
(2)< M����H2O![]() MOH��H�� 1��10��a mol��L��1
MOH��H�� 1��10��a mol��L��1
(3)c(M��)>c(A��)>c(OH��)>c(H��)
(4)�� 0 005��2��10��10
��������(1)��ͼ��֪��0.01 mol��L��1 HA��Һ��pH��2��c(HA)��c(H��)��0.01 mol��L��1����HA��ȫ���롣(2)����ͼ��pH��7ʱ��MOH��������MA��Һ��pH<7��Ϊǿ�������Σ���ˮ�����ӷ���ʽΪM����H2O![]() MOH��H������ʱ��ˮ�������c(OH��)ˮ��c(H��)��1��10��a mol��L��1��(3)K��Ϊ�����ʵ���Ũ�ȵ�MA��MOH�Ļ����Һ������MOH����ʹpH>7����c(M��)>c(A��)>c(OH��)>c(H��)��(4)���������غ㣬K��ʱ��c(M��)��c(MOH)��2c(A��)��pH��10ʱ��c(H��)��10��10 mol��L��1��c(OH��)��10��4 mol��L��1������Һ�е�c(M��)��(0.005��10��4)mol��L��1�������Һ�У����������غ�ã�2c(A��)��c(M��)��c(MOH)�����ݵ���غ�ã�c(A��)��c(OH��)��c(M��)��c(H��)����ʽ��������c(A��)�ã�c(MOH)��c(OH��)��c(M��)��2c(H��)��c(OH��)��(0.005��10��4)mol��L��1��2��10��10 mol��L��1��10��4 mol��L��1��0.005��2��10��10 mol��L��1��
MOH��H������ʱ��ˮ�������c(OH��)ˮ��c(H��)��1��10��a mol��L��1��(3)K��Ϊ�����ʵ���Ũ�ȵ�MA��MOH�Ļ����Һ������MOH����ʹpH>7����c(M��)>c(A��)>c(OH��)>c(H��)��(4)���������غ㣬K��ʱ��c(M��)��c(MOH)��2c(A��)��pH��10ʱ��c(H��)��10��10 mol��L��1��c(OH��)��10��4 mol��L��1������Һ�е�c(M��)��(0.005��10��4)mol��L��1�������Һ�У����������غ�ã�2c(A��)��c(M��)��c(MOH)�����ݵ���غ�ã�c(A��)��c(OH��)��c(M��)��c(H��)����ʽ��������c(A��)�ã�c(MOH)��c(OH��)��c(M��)��2c(H��)��c(OH��)��(0.005��10��4)mol��L��1��2��10��10 mol��L��1��10��4 mol��L��1��0.005��2��10��10 mol��L��1��


