题目内容
【题目】某课外小组设计的实验室制取乙酸乙酯的装置(如图所示),A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。按图连接装置,用酒精灯对烧瓶B加热,当观察到D中有明显现象时停止实验。试完成下列问题:
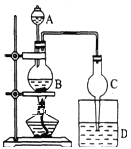
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是:___。
(2)球形干燥管除起冷凝作用外,另一重要作用是___。
(3)在该实验中,若用1mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?___,原因是:___。
【答案】防止暴沸 防止倒吸 否 该反应是可逆反应,进行不完全
【解析】
(1)对于液体加热时,应加入碎瓷片,防止暴沸;
(2)蒸出的乙酸乙酯中混有的乙酸和乙醇极易被饱和碳酸钠溶液吸收,故要有防倒吸措施;
(3)依据酯化反应为可逆反应,可逆反应不能进行到底解答。
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,目的防止烧瓶中液体暴沸;
(2) 蒸出的乙酸乙酯中混有的乙酸和乙醇极易被饱和碳酸钠溶液吸收,故球形干燥管除起冷凝作用外,另一重要作用是防止倒吸;
(3)酯化反应为可逆反应,可逆反应不能进行到底,所以若用1mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应,不能生成1mol乙酸乙酯。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目