题目内容
I.氮是动植物生长不可缺少的元素,含氮化合物是重要的化工原料,研究CO、NOX等大气污染气体的处理具有重要意义.
(1)下列过程没有起到氮的固定作用的是 (填选项).
A.N2与O2反应生成NO B.NH3经催化氧化生成NO
C.N2和H2在一定条件下合成氨D.豆科植物的根瘤菌将空气中氮气转化为含氮化合物
(2)实验室里可以选择下列实验装置中的 (填选项)制取氨气.

写出实验室制取氨气的化学方程式 ,检验氨气是否收集满的方法除用湿润的红色石蕊试纸以外还可以用 .
II.某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.

(1)实验中用装置E制备Cl2,该反应的化学方程式为: ;若有6mol的HCl参加反应,则转移的电子的物质的量为 .
(2)①反应开始一段时间后,观察到B、D两个试管中的晶红溶液出现的现象分别是:B ,D .
②停止通气后,再将B、D两个试管分别加热,两个试管中的现象分别是:
B ,D .
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定 会更强.他们将制得的SO2和Cl2接l:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请结合离子方程式说明产生该现象的原因:
.
(1)下列过程没有起到氮的固定作用的是
A.N2与O2反应生成NO B.NH3经催化氧化生成NO
C.N2和H2在一定条件下合成氨D.豆科植物的根瘤菌将空气中氮气转化为含氮化合物
(2)实验室里可以选择下列实验装置中的

写出实验室制取氨气的化学方程式
II.某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.

(1)实验中用装置E制备Cl2,该反应的化学方程式为:
(2)①反应开始一段时间后,观察到B、D两个试管中的晶红溶液出现的现象分别是:B
②停止通气后,再将B、D两个试管分别加热,两个试管中的现象分别是:
B
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定 会更强.他们将制得的SO2和Cl2接l:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请结合离子方程式说明产生该现象的原因:
分析:I.(1)根据将游离态的氮转化为化合态的氮的过程,叫做氮的固定;
(2)实验室用用加热氯化铵和氢氧化钙固体混合物来制取氨气,用碱石灰来干燥氨气,并用向下排空法收集气体;检验氨气是否收集满,可以利用氨气是减小气体使湿润的红色石蕊试纸变蓝,也可以利用蘸有浓盐酸的玻璃棒靠近集气瓶冒白烟检验;
II.(1)实验室制备氯气利用二氧化锰和浓盐酸反应得到氯化锰、氯气和水;根据化合价的变化计算转移的电子数目;
(2)氯气和二氧化硫都能使品红溶液褪色,但是二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,
(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性.
(2)实验室用用加热氯化铵和氢氧化钙固体混合物来制取氨气,用碱石灰来干燥氨气,并用向下排空法收集气体;检验氨气是否收集满,可以利用氨气是减小气体使湿润的红色石蕊试纸变蓝,也可以利用蘸有浓盐酸的玻璃棒靠近集气瓶冒白烟检验;
II.(1)实验室制备氯气利用二氧化锰和浓盐酸反应得到氯化锰、氯气和水;根据化合价的变化计算转移的电子数目;
(2)氯气和二氧化硫都能使品红溶液褪色,但是二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,
(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性.
解答:解:I.(1)A.N2与O2反应生成NO,属于氮的固定,故A错误;
B.NH3经催化氧化生成NO,是氮的化合态之间的转化,不属于氮的固定,故B正确;
C.N2和H2在一定条件下合成氨,属于氮的固定,故C错误;
D.豆科植物的根瘤菌将空气中氮气转化为含氮化合物,属于氮的固定,故D错误;
故选:B;
(2)实验室用用加热氯化铵和氢氧化钙固体混合物来制取氨气,方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;用碱石灰来干燥氨气,并用向下排空法收集气体,可以利用蘸有浓盐酸的玻璃棒靠近集气瓶,有白烟产生,证明氨气收满;
故答案为:丙;2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;蘸有浓盐酸的玻璃棒靠近集气瓶,有白烟产生,证明氨气收满;
II.(1)实验室制氯气的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,在反应中,每有4mol HCl参与反应,被氧化的氯化氢是2mol,即被氧化的氯化氢占参与反应的50%,6 molHCl参加反应被氧化的氯化氢是3mol,转移的电子的物质的量为3mol;
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O; 3mol;
(2)氯气和二氧化硫都能使品红溶液褪色,但是二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,
故答案为:①品红溶液褪色;品红溶液褪色;
②由无色变为红色;无明显现象;
(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性,离子方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-,生成物都无漂白性;
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;生成物都无漂白性.
B.NH3经催化氧化生成NO,是氮的化合态之间的转化,不属于氮的固定,故B正确;
C.N2和H2在一定条件下合成氨,属于氮的固定,故C错误;
D.豆科植物的根瘤菌将空气中氮气转化为含氮化合物,属于氮的固定,故D错误;
故选:B;
(2)实验室用用加热氯化铵和氢氧化钙固体混合物来制取氨气,方程式为:2NH4Cl+Ca(OH)2
| ||
故答案为:丙;2NH4Cl+Ca(OH)2
| ||
II.(1)实验室制氯气的化学方程式为:MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)氯气和二氧化硫都能使品红溶液褪色,但是二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,
故答案为:①品红溶液褪色;品红溶液褪色;
②由无色变为红色;无明显现象;
(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性,离子方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-,生成物都无漂白性;
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;生成物都无漂白性.
点评:本题考查物质的制备方法、氯气和二氧化碳漂白性的对比实验,题目难度中等,本题注意氨气的检验方法和收集方法,氯气和二氧化碳漂白原理的不同,本题易错点为(2),做题时注意.

练习册系列答案
相关题目
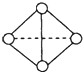
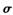 键和
键和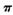 键个数之比为____________。
键个数之比为____________。
 Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式________________________
Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式________________________