题目内容
某混合物含有氯化钠、碳酸钠和氯化钾。经分析知其中氯的质量分数为35.5%,则该混合物中碳酸钠的质量分数可能为( )
| A.20% | B.30% | C.45% | D. 55%。 |
B
氯的相对原子质量为35.5,混合固体35.5/35.5%=100,氯化钠的相对分子质量为58.5,全是NaCl为58.5g,氯化钾的相对分子质量为74.5,全是KCl为74.5g,碳酸钠在25.5g到1.5g之间,B正确。

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
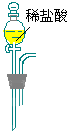
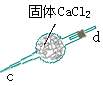

 CO3样品中的NaHCO3分解放出的二氧化碳的体积。
CO3样品中的NaHCO3分解放出的二氧化碳的体积。 CO3和KHCO3的混合物4.60 g,与1.00 mol/L的盐酸反应.
CO3和KHCO3的混合物4.60 g,与1.00 mol/L的盐酸反应. 2)利用所确定的数据,求标准状况下CO2气体的体积(填写下表):
2)利用所确定的数据,求标准状况下CO2气体的体积(填写下表): 气体的体积大于________L,小于________L.
气体的体积大于________L,小于________L.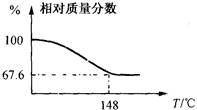
 量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理: 。
量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理: 。
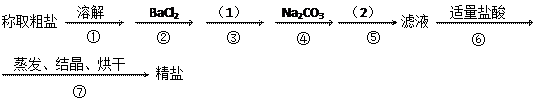
 ②和④可否颠倒_
②和④可否颠倒_ 操作⑤,将对实验
操作⑤,将对实验 结果产生影响,其原因是:
结果产生影响,其原因是: