题目内容
铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)基态铬原子的价电子排布式为 。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为:K2Cr2O2+3CCl4
2KC+2CrO2Cl2+3COCl2↑。
①上述反应式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于 晶体。
③COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO FeO(填”<”、 “=”或 “>”)。
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O],其结构如图。下列说法不正确的是 (填标号)。
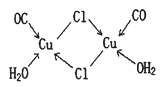
A.该复合物中存在化学健类型只有离子键、配位键
B.该复合物中Cl原子的杂化类型为sp3
C.该复合物中只有CO和H2O作为配位体
D.CO与N2的价电子总数相同,其结构为C=O
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
(13分)(1)3d54s1(2分)
(2)①O>Cl>C(2分)
②分子(1分)
③3∶1(2分)
(3)>(2分)
(4)A、C(2分)
(5)N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F原子,偏离N原子,使得N原子上的孤对电子难与Cu2+形成配位键(或其他合理答案)(2分)
【解析】
试题分析:(1)铬为24号元素,由能量最低原理、洪特规则可知,基态铬原子的价电子排布式为3d54s1;(2)①O、C、Cl均为非金属,非金属性或电负性:O>Cl>C;②CCl4由分子构成,由相似相溶原理可知,固态CrO2Cl2是分子晶体;③由题意可知,1个COCl2含有1个C=O键、2个C—Cl键,单键都是σ键,双键中1个为σ键,另一个为π键,则COCl2分子中σ键和π键的个数比为3∶1;(3)由题意可知,晶格能:NiO>FeO,则熔点:NiO>FeO;(4)A、读图可知,该复合物中含有共价键,错误;B、氯原子以共价键和配位键与铜结合,则氯原子采取sp3杂化方式,错误;C、氯原子也是配体,错误;D、CO与N2互为等电子体,正确;(5)N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F原子,偏离N原子,使得N原子上的孤对电子难与Cu2+形成配位键。
考点:考查电子排布式、电负性、晶体类型、σ键和π键、晶体的熔点、配位键、杂化轨道、等电子体等相关知识。

 名校课堂系列答案
名校课堂系列答案 不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.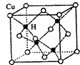 所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为
所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为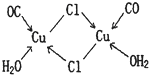
 [化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
[化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.