题目内容
 [化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
[化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.(1)写出Fe2+的核外电子排布式
(2)[cr(H2O)4Cl2]Cl?2H2O中cr的配位数为
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,推测Ni(CO)n的晶体类型
(4)常温下,碳与氢以原子个数比1:1形成的气态氢化物中,其分子中的σ键和П键的数目比是
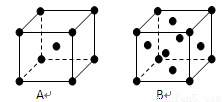
(5)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如右图所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为
分析:(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理写出Fe2+基态离子核外电子排布式;将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,同时还生成KNO2和H2O,依据化学方程式的书写原则,原子守恒,氧化还原反应的化合价升降总数相同进行相等;
(2)根据配合物组成判断配位数,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,以此书写结构式;
(3)根据其状态、熔点判断四羰基镍的晶体类型;
Ni的价电子数为10,每个配体提供一个电子对,根据10+2n=18计算;
等电子体中原子数和价电子数都相同;
(4)常温下,碳与氢以原子个数比1:1形成的气态氢化物为乙炔(C2H2),1个单键是1个σ键,1个双键中含有1个σ键1个П键,1个三键中含有1个σ键2个П键,乙炔分子中,碳原子的sp1杂化轨道和氢原子的1s轨道形成共价键;
(5)利用均摊法计算该晶胞中含有的铜原子和氢原子个数,再根据质量、密度和体积之间的关系式计算,设晶胞的边长为a,利用a=
解答;
(2)根据配合物组成判断配位数,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,以此书写结构式;
(3)根据其状态、熔点判断四羰基镍的晶体类型;
Ni的价电子数为10,每个配体提供一个电子对,根据10+2n=18计算;
等电子体中原子数和价电子数都相同;
(4)常温下,碳与氢以原子个数比1:1形成的气态氢化物为乙炔(C2H2),1个单键是1个σ键,1个双键中含有1个σ键1个П键,1个三键中含有1个σ键2个П键,乙炔分子中,碳原子的sp1杂化轨道和氢原子的1s轨道形成共价键;
(5)利用均摊法计算该晶胞中含有的铜原子和氢原子个数,再根据质量、密度和体积之间的关系式计算,设晶胞的边长为a,利用a=
| 3 |
| ||||
解答:解:(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理知,该离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6;
将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,同时还生成KNO2和H2O,配平得到化学方程式为:Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O;
故答案为:Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O;
(2)[Cr(H2O)4Cl2]Cl?2H2O中Cr与4个H2O,2个Cl-形成配位键,所以配位数为6,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为 ;
;
故答案为:6; ;
;
(3)Ni(CO)4是液态挥发性物质,所以其熔点较低,故为分子晶体;
Ni的价电子数为10,每个配体提供一个电子对,则10+2n=18,故n=4,
等电子体中原子数和价电子数都相同,则 CN-、N2、CO的原子数都是2,价电子数都是10,则互为等电子体,
故答案为:分子晶体;4;CN-;
(4)常温下,碳与氢以原子个数比1:1形成的气态氢化物为乙炔(C2H2),分子中含有2个单键,1个三键,所以分子中含31个σ键,2个П键,分子中的σ键和П键的数目比是3:2;乙炔分子中,碳原子的sp1杂化轨道和氢原子的1s轨道形成共价键;
故答案3:2;碳原子的sp1杂化轨道和氢原子的1s轨道;
(5)该晶胞中含有4个H原子,铜原子个数=
×8+6×
=4,所以该晶胞中含有4个铜原子4个氢原子,设该晶胞的边长为a,则a=
=
;
故答案为:
;
将Fe2O3、KNO3、KOH混合加热共融可制取绿色净水剂K2FeO4,其中KNO3被还原为KNO2,同时还生成KNO2和H2O,配平得到化学方程式为:Fe2O3+3KNO3+4KOH
| ||
故答案为:Fe2O3+3KNO3+4KOH
| ||
(2)[Cr(H2O)4Cl2]Cl?2H2O中Cr与4个H2O,2个Cl-形成配位键,所以配位数为6,CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为
 ;
;故答案为:6;
 ;
;(3)Ni(CO)4是液态挥发性物质,所以其熔点较低,故为分子晶体;
Ni的价电子数为10,每个配体提供一个电子对,则10+2n=18,故n=4,
等电子体中原子数和价电子数都相同,则 CN-、N2、CO的原子数都是2,价电子数都是10,则互为等电子体,
故答案为:分子晶体;4;CN-;
(4)常温下,碳与氢以原子个数比1:1形成的气态氢化物为乙炔(C2H2),分子中含有2个单键,1个三键,所以分子中含31个σ键,2个П键,分子中的σ键和П键的数目比是3:2;乙炔分子中,碳原子的sp1杂化轨道和氢原子的1s轨道形成共价键;
故答案3:2;碳原子的sp1杂化轨道和氢原子的1s轨道;
(5)该晶胞中含有4个H原子,铜原子个数=
| 1 |
| 8 |
| 1 |
| 2 |
| 3 |
| ||||
| 3 |
| ||
故答案为:
| 3 |
| ||
点评:本题考查较为综合,题目难度较大,涉及晶胞的计算、价电子排布式的书写、等电子体、化学键等知识点,晶胞的计算是学习难点,应熟练掌握.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目