题目内容
【题目】工业上常用铁质容器盛装冷浓硫酸。某学习小组为研究铁质材料与热浓硫酸的反应,设计了以下探究活动:
称取铁钉(碳素钢)6.0 g放入15.0 mL浓硫酸中,加热,充分应后得到溶液M并收集到气体N。
(1)该小组通过认真分析,认为M溶液中既含有Fe3+,也可能含有Fe2+。若确认溶液中有无Fe2+,应加入的试剂是___________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.NaOH溶液 d.酸性KMnO4溶液
(2)取320 mL(标准状况)气体N通入足量溴水中,然后加入足量BaCl2溶液,经过____________ 、______________(填操作名称)、干燥后,得到固体2.33 g。气体N与溴水反应的化学方程式为_______________,计算推知气体N中SO2的体积分数为_______________。
(3)该小组通过对铁钉的成分和SO2体积分数的分析,认为气体N中还可能含有H2和另外一种气体Q。你认为Q应该是_____________,理由是________________(用化学方程式表示)。
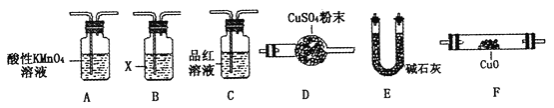
(4)取一定量N,利用下列仪器设计一个能同时检验N中含有H2和气体Q的装置(夹持仪器、橡胶管和加热装置省略),仪器的连接顺序是_____________(填字母),其中A的作用是_____________,B中试剂X的化学式是_____________________。
【答案】d 过滤 洗涤 SO2+Br2+2H2O=H2SO4+2HBr 70% CO2 C + 2H2SO4 (浓)![]() 2SO2↑+ CO2↑+ 2H2O A-C-B-E-F-D(或A-C-B-E-F-D-E) 除去N中的SO2, Ca(OH)2 或Ba(OH)2
2SO2↑+ CO2↑+ 2H2O A-C-B-E-F-D(或A-C-B-E-F-D-E) 除去N中的SO2, Ca(OH)2 或Ba(OH)2
【解析】
(1)Fe+2Fe3+=3Fe2+,+2价亚铁离子能使酸化的高锰酸钾褪色,溶液中已经有+3价铁离子,选择a会造成干扰,选b只能检验溶液中含有+3价铁离子,选c会造成两种沉淀,受氢氧化铁颜色的影响无法辨别,只能选d,故答案为:d;
(2)SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,生成的硫酸遇到氯化钡会产生白色沉淀,可以先洗涤然后再过滤来获得纯净的硫酸钡沉淀,则n(混合气体)=![]() ≈0.014mol,
≈0.014mol,
SO2~BaSO41mol 233g
n 2.33g
n=0.01mol
则SO2的体积分数:![]() ×100%≈70%,故答案为:过滤;洗涤;SO2+Br2+2H2O=2HBr+H2SO4;70%;
×100%≈70%,故答案为:过滤;洗涤;SO2+Br2+2H2O=2HBr+H2SO4;70%;
(3)在反应的过程中,碳单质可以和浓硫酸反应生成二氧化碳、二氧化硫等气体,故答案为:CO2;C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(4)推断所的气体中可能含有二氧化碳,结合图中设计装置的目的,可知检验二氧化碳的方法是首先将二氧化硫除去→确认二氧化硫已经完全除去→澄清石灰水,对于氢气的检验则可通过与灼热氧化铜的反应现象和对产物水的验证来实现,验证气体存在的顺序为:SO2→CO2→CO和H2被氧化→H2O→CO2,实验中要避免其它物质的性质干扰,顺序为:A-C-B-E-F-D(或A-C-B-E-F-D-E),其中A酸性高锰酸钾溶液的作用是除去二氧化碳中的SO2,B中试剂X的作用是除去二氧化硫,可以用Ca(OH)2或Ba(OH)2,
故答案为:A-C-B-E-F-D(或A-C-B-E-F-D-E);除去N中的SO2;Ca(OH)2或Ba(OH)2.

【题目】Ⅰ.课堂上,老师提问如何鉴别浓硫酸与稀硫酸,某学习小组设计方案如下
方案 | 结论 | |
① | 往酸中投入火柴梗 | 变黑者为浓硫酸 |
② | 加入铝片 | 产生刺激性气味者为浓硫酸 |
② | 加少量酸于盛水的小烧杯中 | 放热者为浓硫酸 |
④ | 用玻璃棒蘸浓氨水靠近酸的瓶口 | 冒白烟者为浓硫酸 |
⑤ | 将酸滴加到胆矾晶体上 | 变白者为浓硫酸 |
(1)以上方案中,可行的是______________(填序号)
(2)其中一个稍作改进就能成为可行方案是________________,改进方法为____________。
(3)完全错误的是__________,因为_________________________________________。
Ⅱ.实验室用浓硫酸配制1.0mol/L硫酸溶液480mL,回答下列问题:
(1)如下图所示的仪器中配制溶液肯定不需要的是____________(填字母),配制上述溶液还需要用到的玻璃仪器是_________________________(填仪器名称)。

(2)容量瓶上标有以下5项中的_____________(填序号)
①压强 ②温度 ③容量 ④浓度 ⑤刻度线
(3)在配制过程中,下列操作使所配溶液浓度偏大的是______________(填序号)。
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
③定容时,仰视刻度线
④使用容量瓶前用蒸馏水洗涤且没干燥
(4)计算实验室配制上述溶液需用量筒取质量分数为98%、密度为1.84g/mL的浓硫酸的体积为_____________________mL。(保留小数点后一位)
【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)

ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。