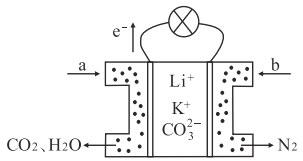
题目内容
【题目】某课外兴趣小组为探究某种铝合金(合金元素为 Mg、Al)是否符合国家质量标准(国 家规定其中铝含量不能低于 78%),设计如图所示装置进行实验. 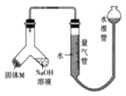
(1)如何检验该装置的气密性?
(2)合金样品固体 M 与氢氧化钠溶液反应的离子方程式是 .
(3)倾斜左边装置使氢氧化钠溶液(足量)与质量为 a 的合金粉末(固体 M)充分反应,待反应停止后,进入量气管气体的体积为 V mL(已折算成标准状况).若量气管最大量 为 50mL,则固体 M 中铝的质量[m(Al)]范围为 .
(4)为了准确地测量氢气的体积,在读取量气管中液面读数的过程中,应注意:①读数时 视线与凹液面最低处相平,②
(5)若 a=38mg,V=44.8mL(标准状况),通过计算可知,该合金中铝的质量分数为(精确到小数点后 1 位).
(6)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积(填“>”“<”或“=”)V.
【答案】
(1)安装好装置并在量气管内加入水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装置密封
(2)2OH﹣+2Al+2H2O═2AlO2﹣+3H2↑
(3)0<mAl<0.04g
(4)调节量气管和水准管液面相平
(5)94.7%
(6)>
【解析】解:(1)检验装置的气密性常用方法为利用气体的热胀冷缩或液封气体形成液面高度差,由装置图可知适合选择液封气体形成液面高度差,检验该装置气密性的方法为:安装好装置并在量气管内加人水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装置密封, 所以答案是:安装好装置并在量气管内加入水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装置密封;(2)铝与氢氧化钠、水反应生成偏铝酸钠、氢气,反应离子方程式为2OH﹣+2Al+2H2O═2AlO2﹣+3H2↑,
所以答案是:2OH﹣+2Al+2H2O═2AlO2﹣+3H2↑;(3)量气管最大量程为50mL,则产生氢气的体积为50mL,所以氢气的最大物质的量为 ![]() =
= ![]() mol,根据电子转移守恒可知3n(Al)=2n(H2)=
mol,根据电子转移守恒可知3n(Al)=2n(H2)= ![]() mol×2,故铝的最大质量为
mol×2,故铝的最大质量为 ![]() ×
× ![]() mol×2×27g/mol=0.04g,所以金属铝的质量范围为0<mAl<0.04g,
mol×2×27g/mol=0.04g,所以金属铝的质量范围为0<mAl<0.04g,
所以答案是:0<mAl<0.04g;(4)为了准确地测量氢气的体积,在读取量气管中液面读数的过程中,应注意:①读数时 视线与凹液面最低处相平,②调节量气管和水准管液面相平,所以答案是:调节量气管和水准管液面相平;(5)44.8mL氢气的物质的量为 ![]() =0.002mol,根据电子转移守恒可知3n(Al)=2n(H2)=0.002mol×2=0.004mol,所以合金中铝的质量
=0.002mol,根据电子转移守恒可知3n(Al)=2n(H2)=0.002mol×2=0.004mol,所以合金中铝的质量 ![]() ×0.004mol×27g/mol=0.036g,合金中Al的质量分数为
×0.004mol×27g/mol=0.036g,合金中Al的质量分数为 ![]() ×100%=94.7%,所以答案是:94.7%;(5)Mg、Al都与盐酸反应生成氢气,改用盐酸生成氢气的体积增大,
×100%=94.7%,所以答案是:94.7%;(5)Mg、Al都与盐酸反应生成氢气,改用盐酸生成氢气的体积增大,
所以答案是:>.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。 用0.100mol![]() L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
L-1硫酸滴定,写出该中和反应的热化学方程式____________(中和热ΔH=-57.3 kJ/mol)。将该烧碱样品配成500mL待测溶液需要的玻璃仪器有_________________________。
(3)滴定过程中,眼睛应注视_________________,若用酚酞作指示剂达到滴定终点颜色变化是____________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是_____molL-1,烧碱样品的纯度是____(保留小数点后两位)
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
① 观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果____。
② 若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果______________。
【题目】Ⅰ.溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
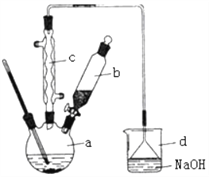
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液态溴。向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生的化学方程式为_______________________;继续滴加至液溴滴完。仪器a的名称是___________装置d中的作用是_______________________。仪器c为冷凝管,其进水口为__________________(填“上”或“下”)口。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______________________。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为____,要进一步提纯,下列操作中必须的是____。
A.重结晶 B.过滤 C.蒸馏 D.萃取