��Ŀ����
����Ŀ���������˻ᡰ���ơ����ȼ���DZ��飨C3H8��������������ȼ���DZ�ϩ��C3H6��
��1����������ɵñ�ϩ����֪��C3H8��g����CH4��g��+HC��CH��g��+H2��g����H1=+156.6kJmol��1CH3CH=CH2��g����CH4��g��+HC��CH��g����H2=+32.4kJmol��1 ����ͬ�����£���ӦC3H8��g����CH3CH=CH2��g��+H2��g���ġ�H=kJmol��1
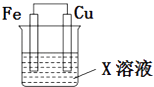
��2���Ա���Ϊȼ����������ȼ�ϵ�أ���ص�����ͨ��O2 �� ����ͨ����飬�����������̼���Σ�����ܷ�Ӧ����ʽΪ���ŵ�ʱ��CO32�������ص������������������
��3��̼�⻯������ȫȼ������CO2��H2O�����³�ѹ�£������е�CO2����ˮ���ﵽƽ��ʱ����Һ��pH=5.60��c��H2CO3��=1.5��10��5 molL��1 �� ������ˮ�ĵ��뼰H2CO3�ĵڶ������룬��H2CO3![]() HCO3��+H+��ƽ�ⳣ��K1= �� ����֪��10��5.60=2.5��10��6��
HCO3��+H+��ƽ�ⳣ��K1= �� ����֪��10��5.60=2.5��10��6��
��4�������£�0.1molL��1NaHCO3��Һ��pH����8������Һc��H2CO3��c��CO32���������������=����������ԭ�����������ӷ���ʽ������˵����
���𰸡�
��1��+124.2
��2��C3H8+5O2�T3CO2+4H2O����
��3��4.2��10��7 mol?L��1
��4������ HCO3��![]() CO32��+H+,HCO3��+H2O
CO32��+H+,HCO3��+H2O ![]() H2CO3+OH��,
H2CO3+OH��,
����������1��������֪��Ӧ��Ŀ�귴Ӧ�����ø�˹���ɿ�֪��ӦC3H8��g����CH3CH=CH2��g��+H2��g������֪�ķ�Ӧ����õ������H=��H1����H2����2������ͨ����飬̼Ԫ�صĻ��ϼ����ߣ���ص�����ͨ��O2����Ԫ�صĻ��ϼ۽��ͣ��Դ�����д����ܷ�Ӧ����ʽ��ԭ��������������ƶ�����3��H2CO3![]() HCO3��+H+��ƽ�ⳣ��Ka=
HCO3��+H+��ƽ�ⳣ��Ka= ![]() �����ú���ˮ�ĵ��뼰H2CO3�ĵڶ������룬����Һ��pH=5.60��֪c��H+����Ȼ�������㣻��4��NaHCO3��Һ��pH����8����ˮ����ڵ��룬ˮ������H2CO3����������CO32����
�����ú���ˮ�ĵ��뼰H2CO3�ĵڶ������룬����Һ��pH=5.60��֪c��H+����Ȼ�������㣻��4��NaHCO3��Һ��pH����8����ˮ����ڵ��룬ˮ������H2CO3����������CO32����
�⣺��1����C3H8��g����CH4��g��+HC��CH��g��+H2��g����H1=+156.6kJmol��1�٣�
CH3CH=CH2��g����CH4��g��+HC��CH��g����H2=+32.4kJmol��1 �ڣ�
����ݸ�˹���ɣ���ӦC3H8��g����CH3CH=CH2��g��+H2��g�����ɢ٩��ڵõ���
���ԡ�H=��H1����H2=+156.6kJmol��1����+32.4kJmol��1��=+124.2kJmol��1�����Դ��ǣ�+124.2����2������ͨ����飬̼Ԫ�صĻ��ϼ����ߣ���ص�����ͨ��O2����Ԫ�صĻ��ϼ۽��ͣ���������������Ӧ���ɶ�����̼��ˮ��
���ص��ܷ�ӦΪC3H8+5O2�T3CO2+4H2O��ԭ��������������ƶ�����CO32�������صĸ�����
���Դ��ǣ�C3H8+5O2�T3CO2+4H2O��������3������ˮ�ĵ��뼰H2CO3�ĵڶ������룬pH=5.60��c��H+��=10��5.60=2.5��10��6molL��1��
��H2CO3![]() HCO3��+H+��
HCO3��+H+��
ƽ��ʱc��H+��=c��HCO3����=2.5��10��6molL��1��
c��H2CO3��=��1.5��10��5��2.5��10��6��molL��1��
��Ka= ![]() =4.2��10��7 molL��1�����Դ��ǣ�4.2��10��7 molL��1����4��NaHCO3��Һ��pH����8����ˮ����ڵ��룬ˮ������H2CO3����������CO32������HCO3��
=4.2��10��7 molL��1�����Դ��ǣ�4.2��10��7 molL��1����4��NaHCO3��Һ��pH����8����ˮ����ڵ��룬ˮ������H2CO3����������CO32������HCO3��![]() CO32��+H+��HCO3��+H2O
CO32��+H+��HCO3��+H2O ![]() H2CO3+OH����
H2CO3+OH����
����c��H2CO3����c��CO32���������Դ��ǣ�����HCO3��![]() CO32��+H+��HCO3��+H2O
CO32��+H+��HCO3��+H2O ![]() H2CO3+OH����
H2CO3+OH����
�����㾫�����������⣬������Ҫ�˽⻯ѧƽ��ļ���(��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%)��

����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о�NO2��NO��CO��NO2- �ȴ�����Ⱦ���ˮ��Ⱦ��Ĵ����Խ��������й�������Ҫ���塣
��1����֪����NO2 + CO ![]() CO2 + NO �÷�Ӧ��ƽ�ⳣ��ΪK1����ͬ��
CO2 + NO �÷�Ӧ��ƽ�ⳣ��ΪK1����ͬ��
ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����������ֱ�Ϊ
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
��N2(g)+O2(g) ![]() 2NO(g) ��H��+179.5 kJ/mol K2
2NO(g) ��H��+179.5 kJ/mol K2
��2NO(g) +O2(g)![]() 2NO2(g) ��H��-112.3 kJ/mol K3
2NO2(g) ��H��-112.3 kJ/mol K3
��д��NO��CO��Ӧ��������Ⱦ��������Ȼ�ѧ����ʽ____________________________�Լ����Ȼ�ѧ����ʽ��ƽ�ⳣ��K=____________����K1��K2��K3��ʾ��
��2����Ⱦ������NO2��CO��һ�������µķ�ӦΪ��2NO2+4CO![]() 4CO2+N2��ij�¶��£���1L�ܱ������г���0.1mol NO2��0.2mol CO����ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊԭ����
4CO2+N2��ij�¶��£���1L�ܱ������г���0.1mol NO2��0.2mol CO����ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊԭ����![]() ����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=________��
����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=________��
�����¶��£�ijʱ�̲��NO2��CO��CO2��N2��Ũ�ȷֱ�Ϊamol/L��0.4mol/L��0.1mol/L��1mol/L��Ҫʹ��Ӧ���淴Ӧ������У�a��ȡֵ��Χ________________��
��3���绯ѧ����NO2-��ԭ������ͼ��
����Դ�ĸ�����____________����A��B��������ӦʽΪ________________��
������������ת����6mol���ӣ���Ĥ������Һ�������仯��![]() Ϊ_____g��
Ϊ_____g��