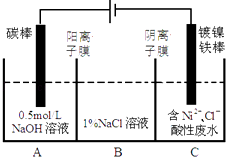
题目内容
【题目】选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转(指针偏转程度大),则其可能的组合共有( ) 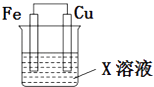
A.6种
B.5种
C.4种
D.3种
【答案】B
【解析】该装置是原电池,根据原电池的构成条件选择电极和电解质溶液,有相对活泼的金属和不活泼的金属或导电的非金属作电极,且较活泼的金属能自发的和电解质溶液进行氧化还原反应,据此分析解答.
解:该装置是原电池,根据原电池的构成条件选取电极和电解质溶液.
当电解质溶液为稀硫酸时,只有铁能作负极,则正极可以是铜,也可以是铂,所以有两种组合;
当电解质溶液为硫酸铁时,负极可以是铁,则正极可以是铜,也可以是铂;若负极为铜时,正极只能是铂,所以有三种组合;
所以通过以上分析知,能构成原电池的组合有5种,
故选:B.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需的化学元素,其配方如下表:
离子 | K+ | Na+ | Mg2+ | Ca2+ | N03- | H2PO3- | SO42- | Zn2+ |
培养液浓度(mol/L) | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中植物根细胞吸收量最少的离子是
A. N03- B. SO42- C. Zn2+ D. H2PO3-