题目内容
8.一定温度下向2L恒溶密闭容器中加入0.2molNO和0.1molCl2,发生反应2NO(g)+Cl2(g)?2ClNO(g)△H,10min后反应达到平衡,测得n(Cl2)=2.5×10-2mol.下列说法错误的是( )| A. | 0-10min的平均反应速率:n(ClNO)=7.5×10-3mol•L-1•min-1 | |
| B. | 平衡时NO的转化率为75% | |
| C. | 其它条件保持不变,反应若在恒压条件下进行,平衡时NO的转化率变大 | |
| D. | 升高温度,反应的平衡常数减小,则△H>0 |
分析 一定温度下向2L恒溶密闭容器中加入0.2molNO和0.1molCl2,10min后反应达到平衡,测得n(Cl2)=2.5×10-2mol,反应的氯气物质的量=0.1mol-0.025mol=0.075mol;
2NO(g)+Cl2(g)?2ClNO(g)
起始量(mol) 0.2 0.1 0
变化量(mol) 0.15 0.075 0.15
平衡量(mol) 0.05 0.025 0.15
A、反应速率V=$\frac{△c}{△t}$计算得到;
B、转化率=$\frac{消耗量}{起始量}$×100%;
C、恒压条件下进行时反应过程中为保持恒压,体积缩小,对恒容容器中相当于压强增大,过程中使平衡正向进行;
D、升高温度,反应的平衡常数减小,说明平衡逆向进行,升温平衡向吸热反应方向进行.
解答 解:一定温度下向2L恒溶密闭容器中加入0.2molNO和0.1molCl2,10min后反应达到平衡,测得n(Cl2)=2.5×10-2mol,反应的氯气物质的量=0.1mol-0.025mol=0.075mol;
2NO(g)+Cl2(g)?2ClNO(g)
起始量(mol) 0.2 0.1 0
变化量(mol) 0.15 0.075 0.15
平衡量(mol) 0.05 0.025 0.15
A、0-10min的平均反应速率:n(ClNO)=$\frac{△c}{△t}$=$\frac{\frac{0.15mol}{2L}}{10min}$=0.0075mol/L•min=7.5×10-3mol•L-1•min-1,故A正确;
B、平衡时NO的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.15mol}{0.2mol}$×100%=75%,故B正确;
C、恒压条件下进行时反应过程中为保持恒压,体积缩小,对恒容容器中相当于压强增大,过程中使平衡正向进行,平衡时NO的转化率变大,故C正确;
D、升高温度,反应的平衡常数减小,说明平衡逆向进行,升温平衡向吸热反应方向进行,逆向是吸热反应,正反应为放热反应,△H<0,故D错误;
故选D.
点评 本题考查了化学平衡的计算应用,主要是一些化学平衡的因素分析判断,平衡移动原理的理解应用是解题关键,题目难度中等.

| A. | 氢氧化钡溶液与硫酸的反应OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃中C的百分含量越高 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减少,则y>4 | |
| D. | 相同质量的烃,完全燃烧,消耗O2越多,烃中H的百分含量越高 |
| A. | 1<n<2 | B. | 1<n<5 | C. | 2<n<4 | D. | 2<n<5 |
| A. | X的能量一定高于M | |
| B. | Y的能量一定高于N | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 因是放热反应,故不必加热反应就一定能发生 |
| A. | 以上反应均可发生 | B. | 只有①不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
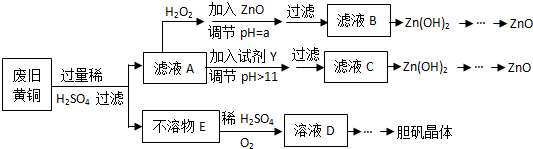
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(1)加入ZnO调节pH=a的目的是使溶液中的Fe3+完全沉淀,Zn2+不被沉淀,a的范围是3.0≤a<5.9.
(2)由不溶物E生成溶液D的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O.
(3)滤液A中加入H2O2反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、过滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后沉淀溶解.
| A. | 二氧化氮中混有一氧化氮杂质,可通入氧气将一氧化氮转化为二氧化氮 | |
| B. | 过量的铜与浓硝酸反应一定有一氧化氮生成 | |
| C. | Fe与S混合加热生成FeS2 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
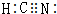 ,HCN中C元素的化合价为+2价.
,HCN中C元素的化合价为+2价.