题目内容
某工业反应混合液中可能含有的组分是乙醚(C4H10O)、乙醇和水。经分析知,液体中各元素的原子数之比为C︰H︰O=16︰42︰5。(1)若该混合液中只含有两种组分,则所有可能的组合是________。
(2)若该混合液中含有三种组分,且知在628g该混合液中有1mol H2O,则此时乙醇和乙醚的物质的量各是多少?
答案:
解析:
解析:
| (1)乙醚和乙醇,乙醚和水。
(2)乙醚7mol,乙醇2mol。 解析:(1)C4H10O、C2H6O、H2O中的n(H)︰n(O)分别为10︰1、6︰1、2︰1、,混合物中n(H)︰n(O)=8.5︰1,则组分中n(H)︰n(O)有大于8.5︰1的,也有小于8.5︰1的,因此,混合液有两种可能:乙醚和水、乙醚和乙醇。 (2)为计算方便,把该混合物写成C16H42O5,则1mol该有机物的质量为314g,628g该有机物即为2mol,即含32mol C、84mol H、10mol O。 设628g混合物中含a mol C4H10O、bmol C2H6O,并已知n(H2O)=1 mol, 有 则乙醚为7 mol,乙醇为2mol。
|

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
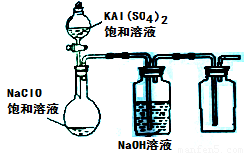
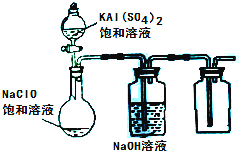
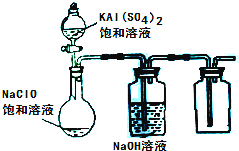 (2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业. (2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.
(2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.