题目内容
5.下列说法正确的是( )| A. | 标况下22.4 L H2O和 1 mol O2所含分子数相等 | |
| B. | 1 mol水中含有2 mol氢和1 mol氧 | |
| C. | 1 mol气态水比1 mol液态水所含的分子数多 | |
| D. | 3 mol O2 与2 mol H2O所含原子数相等 |
分析 A.标况下,水不是气体,不能用气体摩尔体积计算其物质的量;
B.使用物质的量时应指代明确,指明具体的物质或微粒;
C.水由水分子构成,物质的量相同含有分子数目相等;
D.结合每个分子含有原子数目计算原子物质的量,原子物质的量相等则含有原子数目相等.
解答 解:A.标况下,水不是气体,不能用气体摩尔体积计算其物质的量,22.4L水的物质的量远远大于1mol,二者含有分子数目不相等,故A错误;
B.使用物质的量时应指代明确,指明具体的物质或微粒,1mol水中含有2molH原子和1molO原子,故B错误;
C.水由水分子构成,物质的量相同含有分子数目相等,故C错误;
D.3molO2 含有O原子物质的量=3mol×2=6mol,2molH2O所含原子物质的量=2mol×3=6mol,原子物质的量相等则含有原子数目相等,故D正确,
故选D.
点评 本题考查物质的量有关计算,难度不大,注意A选项中气体摩尔体积的使用条件及对象.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
15.硅是重要的半导体材料,构成了现代电子工业的基础.回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为sp3.Si与O的原子数之比为1:3化学式为SiO32-.

(1)基态Si原子中,电子占据的最高能层符号M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为sp3.Si与O的原子数之比为1:3化学式为SiO32-.

16.下列分类正确的是( )
| A. |  | |||||||
| B. |  | |||||||
| C. | 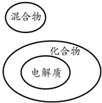 | |||||||
| D. |
| |||||||
13.下列对氧化还原反应的分析中合理的是( )
| A. | 凡是氧化还原反应都有利于生产、生活 | |
| B. | 常温下,钠与氧气的反应属于氧化还原反应,故化合反应都属于氧化还原反应 | |
| C. | 切开金属钠,表面迅速变暗是因为钠与氧气反应,故Na在该反应中作氧化剂 | |
| D. | 反应3S+6NaOH═2Na2S+Na2SO3+3H2O中,S既是氧化剂又是还原剂 |
20.氧族元素碲(Te,和碘同周期)的化合物是一种常用的VCD光记录材料,下列有关该元素叙述中,正确的是( )
| A. | 气态氢化物稳定性:H2Te>H2S | B. | 非金属性:S>Te | ||
| C. | 原子的最外层电子数:S>Te | D. | 原子半径:S>Te |
10.设NA代表阿伏加德罗常数,下列说法中,正确的是( )
| A. | 2.3g金属钠全部变成钠离子时失去的电子数目为0.2NA | |
| B. | 2g氢气所含的原子数目为NA | |
| C. | 17gNH3所含的电子数为10NA | |
| D. | NA个氧分子和NA个氢分子的质量比等于16:1 |
14.以下微粒通常只具有氧化性的是( )
| A. | Fe | B. | Fe2+ | C. | Fe3+ | D. | H2 |
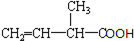 含氧官能团的名称是羧基.
含氧官能团的名称是羧基.