题目内容
【题目】过氧化氢(H2O2)是淡蓝色的黏稠液体,水溶液为无色透明液体,俗称双氧水,可以看作二元弱酸。
(1)H2O2在水中的电离方程式是__________________。
(2)H2O2常被称为“绿色”氧化剂的原因是____________________。
(3)向1 mol/L FeCl2溶液中滴加30%双氧水,除观察到双氧水分解产生的大量无色气泡外,还观察到浅绿色溶液逐渐变为红褐色,并测得其pH由反应前的3.69变为1.84。实验证明所得液体属于胶体,其方法是;_______,上述Fe2+被氧化成红褐色胶体的离子方程式是___________________。
(4)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
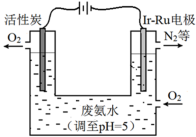
为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH4+)__________c(NO3-)(填“>”、“<”或“=”)。
Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是___________________。
理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是_________g。
【答案】(1)H2O2![]() H++HO2-、HO2-
H++HO2-、HO2-![]() H++O22-(2分)
H++O22-(2分)
(2)其还原产物是H2O,对环境无污染(2分)(3)丁达尔效应(1分)
2Fe2++H2O2+4H2O=2Fe(OH)3(胶体)+4H+(2分)
(4)<(1分)②O2+2H++2e-=H2O2(2分)③17(2分)
【解析】
试题分析:(1)H2O2是二元弱酸,在水中的电离方程式为H2O2![]() H+ + HO2-、HO2-
H+ + HO2-、HO2-![]() H+ + O22-。
H+ + O22-。
(2)双氧水的还原产物是H2O,对环境无污染,因此H2O2常被称为“绿色”氧化剂;
(3)胶体具有丁达尔效应,可以用丁达尔效应。根据电子得失守恒和原子守恒可知Fe2+被氧化成红褐色胶体的离子方程式是2Fe2++H2O2+4H2O = 2Fe(OH)3(胶体)+4H+;
(4)①向废氨水中加入适量硝酸调节溶液的pH约为5,根据电荷守恒,c(H+)+c(NH4+ )=c(OH-)+c(NO3-),则所得废氨水溶液中c(NH4+)<c(NO3-)。
②Ir-Ru惰性电极有吸附O2作用,氧气得电子在酸性介质中生成H2O2 ,则该电极上的反应为O2+2H++2e-=H2O2。
③右端电极处发生的反应有O2+2H++2e-=H2O2、3H2O2+2NH3H2O =N2+8H2O所以理论上电路中每转移3mol电子,生成1.5molH2O2,最多可以处理NH3·H2O的物质的量为1mol,氨气质量是17g。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】下列实验操作能达到实验目的的是( )
选项[ | 实验目的 | 实验操作 |
A | 除去CO2中少量的CO | 点燃 |
B | 除去CuSO4溶液中的少量FeSO4 | 加入足量的铜粉 |
C | 鉴别澄清石灰水和NaOH溶液 | 加入稀盐酸 |
D | 鉴别硬水和软水 | 加入肥皂水 |