题目内容
14.pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100mL①三种溶液中物质的量浓度最大的是CH3COOH;
②分别用0.1mol/L的NaOH(aq)中和,消耗NaOH(aq)的体积分别为V1、V2、V3,它们由大到小的顺序是V1=V2<V3.
③反应开始时,反应速率D.(填A、HCl最快;B、H2SO4最快;C、CH3COOH最快;D、一样快)
分析 ①HCl是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,pH相等的这三种酸中,强电解质溶液浓度小于弱电解质,强电解质溶液中,酸浓度与其酸的元数成反比;
②分别用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的体积与氢离子的物质的量成正比;
③反应速率与氢离子浓度成正比.
解答 解:①HCl是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,pH相等的这三种酸中,强电解质溶液浓度小于弱电解质,强电解质溶液中,酸浓度与其酸的元数成反比,所以pH值相同的 HCl(aq)、H2SO4(aq)、CH3COOH(aq)溶液其浓度大小顺序是CH3COOH>HCl>H2SO4,则浓度最大的是,故答案为:CH3COOH;
②分别用0.1 mol•L-1的NaOH(aq)中和,消耗NaOH(aq)的体积与氢离子的物质的量成正比,pH相等、体积相等的硫酸和盐酸中氢离子的物质的量相等,醋酸的物质的量浓度最大,则相同体积同pH的醋酸和盐酸,醋酸的物质的量大于盐酸,所以消耗氢氧化钠体积V1=V2<V3,故答案为:V1=V2<V3;
③反应速率与氢离子浓度成正比,开始时,三种酸中氢离子浓度相等,所以其开始反应速率相等,故答案为:D.
点评 本题考查较综合,涉及离子浓度大小比较、酸碱混合溶液定性判断等知识点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.已知次氯酸分子的结构式为H-O-Cl,下列有关说法正确的是( )
| A. | 该分子的电子式是H:O:Cl | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线型分子 | D. | O原子发生sp杂化 |
5.下列溶液中,Cl-浓度最大的是( )
| A. | 100mL0.1moL/LKCl溶液 | B. | 1000mL0.1mol/LAlCl3溶液 | ||
| C. | 10mL1mol/LNaCl溶液 | D. | 1mL1mol/LMgCl2溶液 |
2.在溶液中加入足量的Na2O2后仍能大量共存的是( )
| A. | NH4+、NO3-、Ba2+、Cl- | B. | K+、SO42-、Cl-、AlO2- | ||
| C. | NO3-、HCO3-、Ca2+、Mg2+ | D. | Cl-、Na+、CO32-、SO32- |
9.下面有关14C的叙述正确的是( )
| A. | 14C与14N含有相同的中子数 | |
| B. | 14C与C60是同分异构体 | |
| C. | 14C与C60中普通碳原子的化学性质不同 | |
| D. | 14C与12C互为同位素 |
3.化学与生产、生活、环境密切相关.下列有关说法中不正确的是( )
| A. | 燃煤时加入适量生石灰,可减少废气中SO2的排放量 | |
| B. | 氨是制造硝酸、铵盐和纯碱的原料 | |
| C. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| D. | SiC俗称金刚砂,可用作砂纸、砂轮的磨料 |
 3,3,4,6-四甲基辛烷
3,3,4,6-四甲基辛烷 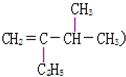 3-甲基-2-乙基-1-丁烯
3-甲基-2-乙基-1-丁烯  2,6-二甲基乙苯.
2,6-二甲基乙苯.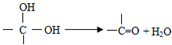 ,如图中X分子式为C4H2Br2O4,为六元环化合物,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰.
,如图中X分子式为C4H2Br2O4,为六元环化合物,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰.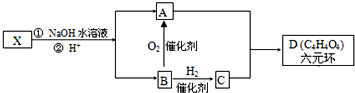
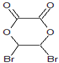 .它可以发生ab反应(填字母)a、取代 b、消去c、加成
.它可以发生ab反应(填字母)a、取代 b、消去c、加成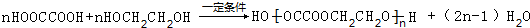 .
.