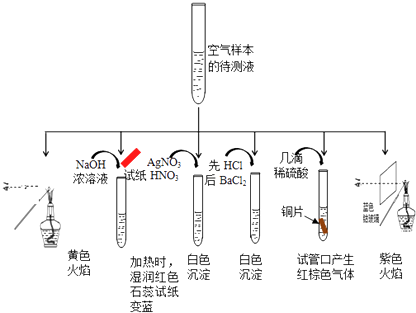
题目内容
【题目】CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2 , 在催化剂的作用下发生反应:CO(g)+Cl2(g)COCl2(g)△H=a kJ/mol
反应过程中测定的部分数据如下表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
(1)反应0~2min末的平均速率v(COCl2)=mol/(Lmin).
(2)在2min~4min间,v(Cl2)正v(Cl2)逆 (填“>”、“=”或“<”),该温度下K= .
(3)在图1中画出0~4min末n(COCl2)随时间的变化示意图 
(4)已知X、L可分别代表温度或压强,如图2表示L一定时,CO的转化率随X的变化关系.X代表的物理量是;a0 (填“>”,“=”,“<”),依据是 
【答案】
(1)0.1
(2)=;5
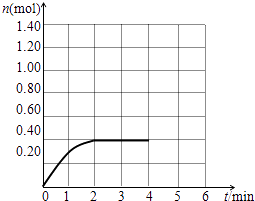
(3)
(4)温度;<;因为X增大时,CO的平衡转化率降低,平衡逆向移动
【解析】解:(1.)由表中数据,可知0~2min内△n(CO)=1.2mol﹣0.8mol=0.4mol,由方程式可知△c(COCl2)=△c(CO)=0.4mol,则v(COCl2)= ![]() 0.1mol/(L.min),故答案为:0.1;
0.1mol/(L.min),故答案为:0.1;
(2.)4min内,反应的氯气为0.6mol﹣0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol﹣0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态,在2min~4min间,v(Cl2)正=v(Cl2)逆 ,
由方程式可知,平衡时生成COCl2为0.4mol,该温度下平衡常数K= ![]() =
= ![]() =5,故答案为:=;5;
=5,故答案为:=;5;
(3.)随时间的变化,COCl2的物质的量增大,开始为0,2min时到达平衡,平衡时COCl2为0.4mol,0~4min末n(COCl2)随时间的变化示意图为:  ,
,
故答案为:  ;
;
(4.)正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应,故a<0,
故答案为:温度;<;因为X增大时,CO的平衡转化率降低,平衡逆向移动.
(1.)由表中数据,可知0~2min内△n(CO)=1.2mol﹣0.8mol=0.4mol,由方程式可知△c(COCl2)=△c(CO)=0.4mol,再根据v= ![]() 计算v(COCl2);
计算v(COCl2);
(2.)4min内,反应的氯气为0.6mol﹣0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol﹣0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态;由方程式可知,平衡时生成COCl2为0.4mol,平衡常数K= ![]() ;
;
(3.)n(COCl2)随时间的变化增大,开始为0,2min时到达平衡,平衡时COCl2为0.4mol;
(4.)正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】根据20℃时某些物质的溶解度(g)数据:
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10﹣3 | 2.55×10﹣2 | 9×10﹣4 | 1.1×10﹣2 |
下列说法不正确的是( )
A.硫酸钙悬浊液中存在CaSO4(s)Ca2+(aq)+SO42﹣(aq)
B.用Na2CO3溶液浸泡锅炉中的水垢,可将水垢中的CaSO4转化为CaCO3
C.向Mg(OH)2悬浊液中滴加FeCl3 , 沉淀变为红褐色,说明溶解度Fe(OH)3<Mg(OH)2
D.向2ml饱和MgCl2 溶液中先后滴加0.1mol/L的Na2CO3、NaOH溶液各2滴,产生的白色沉淀为Mg(OH)2
【题目】将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
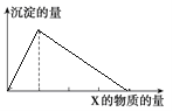
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D