题目内容
【题目】某强酸性溶液X可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣一种或几种,取该溶液进行连续实验,实验过程如下:根据以上信息,回答下列问题:
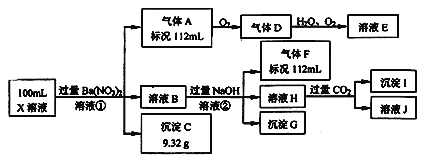
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是________________。为证明该阴离子是否存在,需要加入试剂__________________________(写化学式)。
(2)用离子方程表达下列反应:
①中生成气体A:_____________________________________________。
②中生成溶液H:_______________________________________。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为________mol/L、c(Cl﹣)为_____mol/L。(若离子不存在,请填0mol/L)
【答案】Fe3+、Cl—Ba(NO3)2 HNO3 AgNO33Fe2++4H++NO3﹣=3Fe3++NO↑+2H2OAl3++4OH﹣=AlO2﹣+2H2O0.150
【解析】
在强酸性溶液中一定不会存在CO32-和SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,则溶液中含有SO42-离子;生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3;生成NO说明X溶液中含有还原性离子,则还原性离子为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,则溶液中含有Al3+离子。强酸性溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-。
(1)在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,则溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,则溶液中含有Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,溶液X中含有NH4+离子;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,则溶液中含有Al3+离子。酸性溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-。检验是否含有Cl—,应该先加入Ba(NO3)2溶液排除酸化SO42-离子的干扰,再加入酸化的AgNO3溶液。(2)①反应是Fe2+离子被硝酸氧化为Fe3+离子,硝酸被还原为NO气体,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;②溶液B中Al3+离子与过量氢氧化钠反应生成AlO2-,反应的离子方程式为Al3++4OH﹣=AlO2﹣+2H2O。(3)依据题给数据可知,生成9.32gBaSO4沉淀,说明X溶液中含有0.04molSO42-离子,生成112mlNH3, 溶液中含有NH4+离子物质的量是0.005mol,由生成112mlNO,结合离子方程式3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O可知溶液中含有Fe2+的物质的量是0.015mol,加入氢氧化钠是60ml时,沉淀的量降为0.025mol,即氢氧化铁的物质的量是0.025mol,根据铁元素守恒,溶液中含有Fe3+的物质的量是0.01mol,沉淀质量由0.03mol降为0.025mol ,说明溶液中含有Al3+的物质的量是0.005mol,由电荷守恒可得:3n(Al3+)+3n(Fe3+)+2n(Fe2+)+n(NH4+)=2n(SO42-)+n(Cl﹣),则3×0.005mol+3×0.01mol+2×0.015mol+0.005mol=2×0.04mol+n(Cl﹣),n(Cl﹣)=0mol,故100mlX溶液中c(Fe2+)为0.15mol/L,c(Cl﹣)为0mol/L。