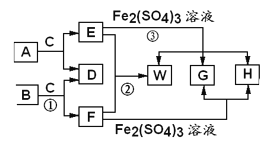
题目内容
【题目】零排放、太阳能、绿色光源等高科技点亮2010上海世博。
(1)世博园区外围设置生态化停车场,有害尾气被纳米光触媒涂料分解为无毒物质,汽车尾气中的下列物质属于由极性键形成的非极性分子的是____。
a.CO b.NO c.NO2 d.CO2
(2)“一轴四馆”中安装了高亮度节能的陶瓷金卤灯,金卤灯中填充物通常包含NA,81Tl、49In、SC,I等元素的单质或化合物.有关说法正确的是_____。
a.第ⅢA元素铊和铟,第一电离能Tl小于In
b.元素Sc位于周期表s区
c.钠的熔点低,是因为金属键较弱
d.I2溶于KI溶液,可产生I3-,由价层互斥理论可推知I3-呈直线形
(3)世博锗广泛采用了冰蓄冷空调.冰蓄冷空调采用液态化合物乙二酵(HOCH2CH2OH)介质,乙二醇沸点高,是由于_____。
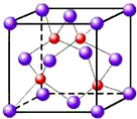
(4)上海城区大规模集中使用“21世纪绿色光源”LED半导体照明,LED晶片采厢砷化镓(GaAs)等材料组成。其中Ga原子在基态时,核外电子排布式为:_____。GaAs的晶胞结构如图,晶胞中含砷原子数为_____。
(5)“东方之冠”(中国馆)表面装有7000多块红色铝板,红色铝板为新型氟碳喷涂型材,一种氟碳涂层聚脂(FEP),它的单体为CF3﹣CF=CF2,该分子中碳原子的杂化方式有:_____。
【答案】d acd 乙二醇分子间存在氢键 [Ar]3d104s24p1 4 sp2、sp3
【解析】
本题主要考察选修3,分子的结构与性质,原子的结构与性质,晶体的结构与性质。
(1)CO、NO都是不同原子组成的双原子分子,含有极性键,属于极性分子,NO2 、CO2中都含有极性键,NO2 分子中N元素化合价为+4,不等于最外层电子数,属于极性分子,而CO2分子中C元素化合价为+4,等于其最外层电子数,故二氧化碳为非极性分子;
故答案为:d;
(2)a.同主族自上而下,第一电离能降低,故第一电离能Tl小于In,故a正确;
b.元素Sc属于过渡元素,位于周期表d区,故b错误;c.金属晶体的熔点取决于金属键强弱,金属键越弱,熔点越低,故c正确;d.I3-离子中心I原子价层电子对数=2+![]() =5,价层电子对模型为三角双锥,中心I原子有3对孤电子对,故I3-离子为直线型结构,故d正确;
=5,价层电子对模型为三角双锥,中心I原子有3对孤电子对,故I3-离子为直线型结构,故d正确;
故答案为:acd;
(3)分析分子晶体的熔沸点,主要从相对分子质量和氢键出发,由于乙二醇分子间存在氢键,优先分析氢键,故其沸点较高;
故答案为:乙二醇分子间存在氢键;
(4)Ga原子核外电子数为31,根据能量最低原理,其基态原子核外电子排布式为:[Ar]3d104s24p1;GaAs为1:1型结构,根据晶胞中红色球可知晶胞中As原子数目为4;
故答案为:[Ar]3d104s24p1;4;
(5)CF3-CF=CF2分子中-CF3中碳原子成4个σ键、没有孤电子对,采取sp3杂化,形成C=C双键的C原子成4个σ键、没有孤电子对,采取sp2杂化;
故答案为:sp2、sp3。

【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
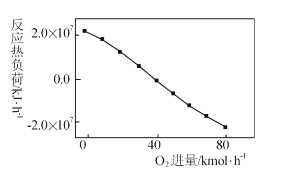
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________