题目内容
11.对反应:CuSO4+FeS2+H2O→Cu2S+FeSO4+H2SO4,下列说法正确的是( )| A. | 氧化剂只有CuSO4 | |
| B. | FeS2既是氧化剂又是还原剂 | |
| C. | 被氧化的硫和被还原的硫的质量比为3:7 | |
| D. | 1molCuSO4可氧化$\frac{5}{7}$mol的硫 |
分析 在CuSO4+FeS2+H2O→Cu2S+FeSO4+H2SO4反应根据得失电子守恒配平的14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,Cu元素的化合价由+2降低为+1,部分S元素的化合价由-1降低到-2,部分S元素的化合价由-1升高到+6价,则Cu2S只是还原产物,FeS2既是作氧化剂,又做还原剂,据此分析.
解答 解:A、因硫酸铜中Cu元素的化合价降低,FeS2中部分S元素的化合价也降低,则硫酸铜、FeS2都是该反应中的氧化剂,故A错误;
B、因FeS2中部分S元素的化合价由-1升高到+6价,部分S元素的化合价由-1升高到+6价,所以FeS2既是作氧化剂,又做还原剂,故B正确;
C、由反应可知,10个S原子中,有3个S原子失去电子,7个S原子得到电子,即被氧化的硫与被还原的硫的质量比为3:7,故C正确;
D、由电子守恒可知,1mol硫酸铜得电子数为1mol,S作还原剂时化合价由-1升高到+6价,则1mol硫酸铜可以氧化$\frac{1}{7}$mol的硫,故D错误;
故选:BC.
点评 本题考查氧化还原反应,难度较大,学生明确反应中各元素化合价的变化是解答的关键,FeS2中Fe、S元素的化合价是解答的难度,并注意氧化还原反应中电子守恒来解答.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
1.从海水中制得的氯化钠除食用外,还可用作T业原料,生成多种含钠或氯的化工产品,利用CO2+NH3+HO2+NaCl═NaHCO3↓+NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图.
饱和食盐水溶液$→_{(1)通入足量的气体B}^{(1)通入足量的气体A}$悬浊液$\stackrel{(3)}{→}$晶体$\stackrel{(4)}{→}$纯碱则相关的说法错误的是( )
饱和食盐水溶液$→_{(1)通入足量的气体B}^{(1)通入足量的气体A}$悬浊液$\stackrel{(3)}{→}$晶体$\stackrel{(4)}{→}$纯碱则相关的说法错误的是( )
| A. | 通入的气体:A是CO2,B是NH3 | |
| B. | NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小 | |
| C. | 步骤(3)的操作为过滤,滤液可作化学肥料 | |
| D. | 步骤(4)中,将晶体加热分解可以得到纯碱 |
2.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4,6-三氯甲苯 |
19.加入NaOH溶液后,溶液中哪种离子数目不会减少( )
| A. | NH4+ | B. | Mg2+ | C. | SO42- | D. | HCO3- |
6.化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.下列做法与社会可持续发展理念相违背的是( )
| A. | 回收利用废旧金属 | B. | 吸收硫酸工业尾气 | ||
| C. | 大力开发不可再生资源 | D. | 改进汽车尾气净化技术 |
16.常温下,下列物质不能用铁制容器盛装的是( )
| A. | 稀盐酸 | B. | 氢氧化钠溶液 | C. | 浓硫酸 | D. | 浓硝酸 |
3.设NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1.7gNH3中含有的电子数为NA | |
| B. | 22.4LH2中含有的氢分子数为NA | |
| C. | 标准状况下,22.4L水中含有的原子数为3NA | |
| D. | 1L 2mol/L Na2SO4溶液中含有的钠离子数为2NA |
1.下列实验操作,处理方法错误的是( )
| A. | 做银镜反应的试管先用NaOH溶液洗涤,倒掉后再用清水冲洗干净 | |
| B. | 皮肤上若沾有少量的苯酚用酒精洗 | |
| C. | 做银镜反应后的试管一般采用浓盐酸洗涤 | |
| D. | 制乙烯的实验温度计应伸入液面下 |
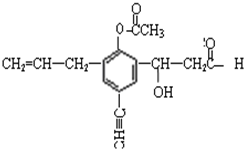 某有机物的结构如下,分析其结构并回答下列问题:
某有机物的结构如下,分析其结构并回答下列问题: