题目内容
下列有关物质“量”的说法正确的是( )A.相同质量的Al和Al2O3分别与等浓度的NaOH溶液反应,至体系中均无固体物质时,Al2O3消耗碱量多
B.反应N2O4+N2H4→N2+H2O中,若有1 mol N2O4参加反应,则有4 mol电子发生转移
C.由Na2CO3和NaHCO3组成的混合物中,若n(Na+):n(C)=7:5,则n(Na2CO3):n(NaHCO3)=2:3
D.1 mol Cl2参加的任何反应,反应过程中转移电子数都是2 NA
【答案】分析:A.令二者质量为1g,最终都生成NaAlO2,根据化学式可知,Al消耗氢氧化钠为n(NaOH)=n(Al)、氧化铝消耗氢氧化钠为n′(NaOH)=2n(Al2O3),据此计算;
B.反应中N2O4被还原,N元素化合价由+4降低为0价,据此计算;
C.令Na2CO3和NaHCO3的物质的量分别为xmol、ymol,根据钠离子、碳原子守恒结合二者比例关系列方程解答;
D.氯气在反应是可能既起氧化剂又起还原剂的作用.
解答:解:A.令二者质量为1g,最终都生成NaAlO2,根据化学式可知,Al消耗氢氧化钠为n(NaOH)=n(Al)=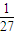 mol、氧化铝消耗氢氧化钠为n′(NaOH)=2n(Al2O3)=2×
mol、氧化铝消耗氢氧化钠为n′(NaOH)=2n(Al2O3)=2×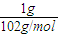 =
=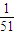 mol,二者消耗的氢氧化钠不相等,故A错误;
mol,二者消耗的氢氧化钠不相等,故A错误;
B.反应中N2O4被还原,N元素化合价由+4降低为0价,有1molN2O4参加反应,则有4 mol电子发生转移的电子为1mol×2×4=8mol,故B错误;
C.令Na2CO3和NaHCO3的物质的量分别为xmol、ymol,则:(2x+y):(x+y)=7:5,整理得x:y=2:3,故C正确;
D.反应Cl2+H2O=HCl+HClO中,1 mol Cl2参加反应,转移电子数为NA,故D错误;
故选C.
点评:本题考查混合物计算、氧化还原反应计算等,难度中等,注意A利用守恒思想的解答,注意基础知识的理解掌握.
B.反应中N2O4被还原,N元素化合价由+4降低为0价,据此计算;
C.令Na2CO3和NaHCO3的物质的量分别为xmol、ymol,根据钠离子、碳原子守恒结合二者比例关系列方程解答;
D.氯气在反应是可能既起氧化剂又起还原剂的作用.
解答:解:A.令二者质量为1g,最终都生成NaAlO2,根据化学式可知,Al消耗氢氧化钠为n(NaOH)=n(Al)=
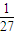 mol、氧化铝消耗氢氧化钠为n′(NaOH)=2n(Al2O3)=2×
mol、氧化铝消耗氢氧化钠为n′(NaOH)=2n(Al2O3)=2×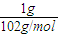 =
=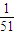 mol,二者消耗的氢氧化钠不相等,故A错误;
mol,二者消耗的氢氧化钠不相等,故A错误;B.反应中N2O4被还原,N元素化合价由+4降低为0价,有1molN2O4参加反应,则有4 mol电子发生转移的电子为1mol×2×4=8mol,故B错误;
C.令Na2CO3和NaHCO3的物质的量分别为xmol、ymol,则:(2x+y):(x+y)=7:5,整理得x:y=2:3,故C正确;
D.反应Cl2+H2O=HCl+HClO中,1 mol Cl2参加反应,转移电子数为NA,故D错误;
故选C.
点评:本题考查混合物计算、氧化还原反应计算等,难度中等,注意A利用守恒思想的解答,注意基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目