题目内容
13.已知如下数据:| 化学键 | 键能/(kJ•mol-1) | 化学键 | 键能/(kJ•mol-1) |
| H-H | 436.0 | I-I | 153 |
| O=O | 497.0 | N=N | 946 |
| O-H | 463.0 | H-I | 297 |
| N-H | 391.0 |
| A. | 氢气的燃烧热为△H=-483kJ/mol | |
| B. | H2(g)+I2(g)$\frac{200℃}{\;}$2HI(g)△H=-5kJ/mol | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol | |
| D. | 在相同条件下,等量的氢气完全燃烧和与氧气组成燃烧电池时,焓变相等 |
分析 A、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据热化学方程式结合△H=反应物的键能之和-生成物的键能之和判断;
B、根据△H=反应物的键能之和-生成物的键能之和判断;
C、根据△H=反应物的键能之和-生成物的键能之和判断;
D、焓变只与反应物的系数以及状态有关.
解答 解:A、由H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=436+497×0.5-2×463=285.5 kJ/mol,可知1mol氢气完全燃烧生成稳定的氧化物放出的热量为285.8KJ,所以氢气的燃烧热△H=-285.5 kJ/mol,故A错误;
B、由H2(g)+I2(g)$\frac{200℃}{\;}$2HI(g)△H=436+153-2×297=-5kJ/mol,故B正确;
C、由N2(g)+3H2(g)?2NH3(g)△H=946+3×436-6×391=-92kJ/mol,故C正确;
D、焓变只与反应物的系数以及状态有关,所以等量的氢气完全燃烧和与氧气组成燃烧电池时,焓变相等,故D正确.
故选A.
点评 本题主要考查了反应热的计算,学生熟记教材知识并灵活应用△H=反应物的键能之和-生成物的键能之和是解题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.目前我省不少城市居民所使用的燃料主要是管道煤气,有的地方已经开始使用天然气作为民用燃料.管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4.它们的燃烧反应如下:
2CO+O2$\stackrel{点燃}{→}$2CO2 2H2+O2$\stackrel{点燃}{→}$2H2O CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是天然气.因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是增大进风口(填增大或减小),如不作改进可能产生的不良结果是天然气不能充分燃烧,可能生成有毒的CO
管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是丁烷遇冷凝结为液体使管道内气流不畅.
2CO+O2$\stackrel{点燃}{→}$2CO2 2H2+O2$\stackrel{点燃}{→}$2H2O CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是天然气.因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是增大进风口(填增大或减小),如不作改进可能产生的不良结果是天然气不能充分燃烧,可能生成有毒的CO
管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点(℃) | -183.3 | -189.7 | -138.4 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 |
2.下列各组物质可用分液漏斗分离的是( )
| A. | 乙酸与乙酸乙酯 | B. | 溴苯与水 | C. | 酒精与水 | D. | 苯与CCl4 |
3.化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.下列做法与社会可持续发展理念相违背的是( )
| A. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| B. | 开发利用可再生能源,减少化石燃料的使用 | |
| C. | 过度开采矿物资源,促进地方经济发展 | |
| D. | 研发可降解高分子材料,减少“白色污染” |
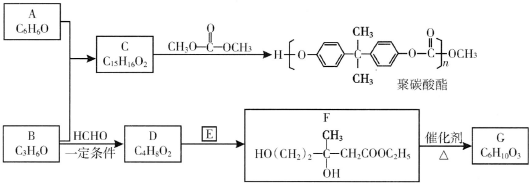
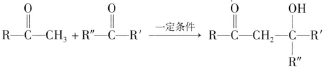 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基) ,E的分子式是C4H8O2,F生成G的反应类型是取代反应?
,E的分子式是C4H8O2,F生成G的反应类型是取代反应? .G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).
.G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).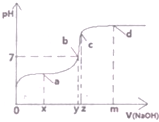 (1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.
(1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.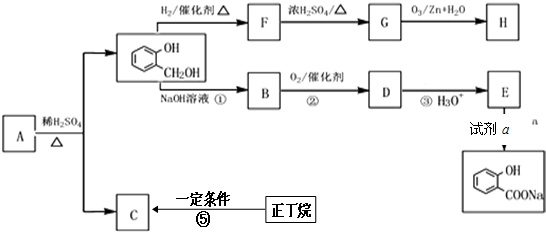
 ,由F到G的反应类型为消去反应.
,由F到G的反应类型为消去反应.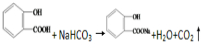 .
.
 的反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论:取少量反应后的溶液于试管中,加入氯化铁溶液,若溶液变紫色,则反应不完全,反应物有剩余,反之则完全反应.
的反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论:取少量反应后的溶液于试管中,加入氯化铁溶液,若溶液变紫色,则反应不完全,反应物有剩余,反之则完全反应.
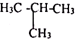 C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.
C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.