题目内容
(14分)化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:
I、用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
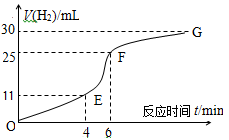
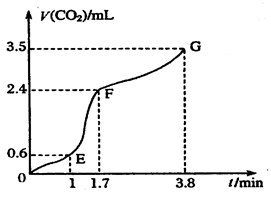
(1)实验过程如图所示,分析判断 段化学反应速率最快。
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是 ,一定时间后反应速率逐渐减慢,其原因是 。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
II、某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
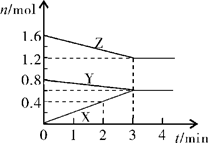
(1)该反应的化学方程式: ;
(2)反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是 。
I、用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:

(1)实验过程如图所示,分析判断 段化学反应速率最快。
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是 ,一定时间后反应速率逐渐减慢,其原因是 。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 E.降低温度 |

(1)该反应的化学方程式: ;
(2)反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是 。
(14分) I、(1)EF;(2)该反应放热,体系温度升高,反应速率加快;盐酸浓度不断减小,反应速率减缓。(3)ACE;
II、 (1)Y+2Z 3X;(2) 0.1;(3)在此条件下该反应已达到反应限度(化学平衡)。
3X;(2) 0.1;(3)在此条件下该反应已达到反应限度(化学平衡)。
II、 (1)Y+2Z
 3X;(2) 0.1;(3)在此条件下该反应已达到反应限度(化学平衡)。
3X;(2) 0.1;(3)在此条件下该反应已达到反应限度(化学平衡)。 I、(1)根据图像可知,EF段斜率最大,所以反应速率最快。
(2)由于该反应放热,体系温度升高,反应速率加快。但当反应进行到一定程度后,盐酸到浓度降低,此时浓度对反应速率的影响超过了温度对反应速率的影响,所以反应速率又逐渐降低。
(3)AC均是稀释,氢离子的浓度降低,反应速率降低。同样降低温度,反应速率也会降低。B对反应速率不影响,D是最大氢离子浓度,反应速率增大。答案选ACE。
II、 (1)根据图像可知,当反应达到平衡时,X的我这里增加了0.6mol,Y的物质的量减少了0.2mol,Z的物质的量减少0.4mol,所以根据变化量之比是相应的化学计量数之比可知,方程式为Y+2Z 3X。
3X。
(2)反应开始至2min末,X的的物质的量增加了0.4mol,所以其反应速率是
 。
。
(3)3min后,XYZ的物质的量不再发生变化,说明反应达到了化学平衡状态。
(2)由于该反应放热,体系温度升高,反应速率加快。但当反应进行到一定程度后,盐酸到浓度降低,此时浓度对反应速率的影响超过了温度对反应速率的影响,所以反应速率又逐渐降低。
(3)AC均是稀释,氢离子的浓度降低,反应速率降低。同样降低温度,反应速率也会降低。B对反应速率不影响,D是最大氢离子浓度,反应速率增大。答案选ACE。
II、 (1)根据图像可知,当反应达到平衡时,X的我这里增加了0.6mol,Y的物质的量减少了0.2mol,Z的物质的量减少0.4mol,所以根据变化量之比是相应的化学计量数之比可知,方程式为Y+2Z
 3X。
3X。(2)反应开始至2min末,X的的物质的量增加了0.4mol,所以其反应速率是
 。
。(3)3min后,XYZ的物质的量不再发生变化,说明反应达到了化学平衡状态。

练习册系列答案
相关题目
 ?2B(g)+C(g) ⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是
?2B(g)+C(g) ⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是

 正反应速率加快的是( )
正反应速率加快的是( ) (OE)、
(OE)、