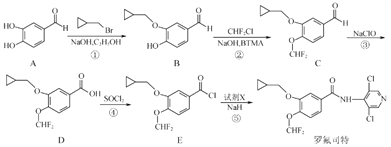
题目内容
【题目】应用 VSEPR 理论判断下表中分子或离子的立体构型。
分子 | 中心原子上弧电子对数 | 中心原子结合的杂化类型 | 分子或离子的立体构型 |
NH2 | _______________ | _______________ | _______________ |
BF3 | _______________ | _______________ | _______________ |
H3O+ | _______________ | _______________ | _______________ |
【答案】 2 sp3 V 形 0 sp2 平面三角形 1 sp3 三角锥形
【解析】①NH2中价层电子对个数=σ键个数+孤电子对个数=2+![]() (5+1-2×1)=4,因此N采取sp3杂化,VSEPR构型为四面体形,由于含有2个孤电子对,所以其空间构型为V形;②BF3分子中价层电子对个数=3+
(5+1-2×1)=4,因此N采取sp3杂化,VSEPR构型为四面体形,由于含有2个孤电子对,所以其空间构型为V形;②BF3分子中价层电子对个数=3+![]() (3-3×1)=3,且不含孤电子对,所以该分子为平面三角形,中心原子采用sp2杂化;③水合氢离子中价层电子对个数=3+
(3-3×1)=3,且不含孤电子对,所以该分子为平面三角形,中心原子采用sp2杂化;③水合氢离子中价层电子对个数=3+![]() (6-1-3×1)=4,且该微粒中含有一个孤电子对,所以水合氢离子为三角锥形,氧原子杂化方式为sp3;故答案为:2;sp3;V 形;0;sp2;平面三角形;1;sp3;三角锥形。
(6-1-3×1)=4,且该微粒中含有一个孤电子对,所以水合氢离子为三角锥形,氧原子杂化方式为sp3;故答案为:2;sp3;V 形;0;sp2;平面三角形;1;sp3;三角锥形。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目