题目内容
以色列科学家Daniel Shechtman因发现准晶体获得2011年诺贝尔化学奖。人们在自然界中也找到了组成为Al63Cu24Fe13的天然准晶体。将相同质量的此准晶体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
| A.n(烧碱)<n(稀硝酸)<n(盐酸) | B.n(烧碱)<n(盐酸)<n(稀硝酸) |
| C.n(稀硝酸)<n(烧碱)<n(盐酸) | D.n(盐酸)<n(稀硝酸)<n(烧碱) |
C
解析试题分析:设该晶体的物质的量是1mol,其中Al、Cu、Fe的物质的量分别是63mol、24mol、13mol。铜与盐酸不反应,则根据方程式2Al+6H+=2Al3++3H2↑、Fe+2H+=Fe2++H2↑可知,铝、铁与盐酸反应生成的氢气分别是94.5mol、13mol,共计是107.5mol。与烧碱反应的是铝,铁与铜和烧碱不反应。因此根据方程式2Al+2OH-+2H2O=2Al3++3H2↑可知,生成的氢气是94.5mol。三种金属与硝酸均反应,稀硝酸的还原产物是NO,反应中氮元素得到3个电子,则根据电子得失守恒可知,反应中生成的NO物质的量= =92mol,所以最终生成气体的物质的量关系是n(稀硝酸)<n(烧碱)<n(盐酸),答案选C。
=92mol,所以最终生成气体的物质的量关系是n(稀硝酸)<n(烧碱)<n(盐酸),答案选C。
考点:考查金属与酸碱反应的有关计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列说法在一定条件下可以实现的是( )
①酸性氧化物与碱发生反应
②弱酸与盐溶液反应可以生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸充分反应后溶液体系为中性
⑤有单质参加的非氧化还原反应
⑥两种氧化物反应有气体生成
| A.①②③④⑤⑥ | B.除⑥外 | C.除④外 | D.除②外 |
下列物质所发生的化学反应中,由于反应物的用量不同而得到不同产物的是
①铁与稀硝酸②AgNO3溶液与氨水溶液③碳酸钠溶液与稀盐酸④铁与氯气⑤NaAlO2溶液和稀盐酸⑥FeCl3溶液与Na2S溶液
| A.全部都是 | B.①②③⑤⑥ | C.①②③⑤ | D.③④⑤ |
下列各组物质中,物质之间不能通过一步反应就能实现图示变化的是
| 选项 | 物质转化关系 | a | b | c | d |
| A | 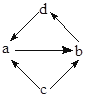 | FeCl2s | FeCl3s | Fe | CuCl2 |
| B | NO | NO2 | N2 | HNO3 | |
| C | Na2CO3 | NaOH | Na2O2 | NaHCO3 | |
| D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
下列物质转化在给定条件下能实现的是
①Al2O3 NaAlO2(aq)
NaAlO2(aq)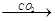 Al(OH)3
Al(OH)3
②S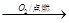 SO3
SO3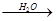 H2SO4
H2SO4
③饱和NaCl(aq)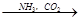 NaHCO3
NaHCO3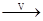 Na2CO3
Na2CO3
④Fe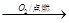 Fe3O4
Fe3O4 FeCl3
FeCl3
| A.①③ | B.②③ | C.②④ | D.①④ |
下列叙述不正确的是( )
| A.金属X能与NaOH溶液反应放出H2,但金属Y不能,则Y的金属性一定比X弱 |
| B.在合成氨反应达到平衡时,只增加N2的物质的量,达新平衡后N2的百分含量增大 |
| C.在铁件上镀铜时,铁和电源负极相连,铜和正极相连,电解质溶液是CuSO4溶液 |
| D.Cl2和SO2等体积充分混合后,通入品红溶液,溶液颜色没有明显变化 |
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热 | 未出现红色沉淀 | 葡萄糖中不含有醛基 |
| B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成, 苯层呈紫色 | 白色沉淀可能为CuI |
| C | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多 且反应速率快 | HA酸性比HB强 |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 | 红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
下列物质间的转化在给定条件下能实现的是
①
②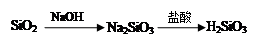
③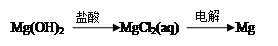
④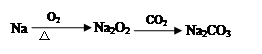
| A.②④ | B.③④ | C.①④ | D.①②③ |
类比推断法是研究物质性质的常用方法之一,可预测许多物质的性质。但类比推断法是相对的,不能违背客观实际。下列说法正确的是
| A.由溶解性CaCO3<Ca(HCO3)2,则溶解性Na2CO3<NaHCO3 |
| B.向Ca(ClO)2溶液中通入少量CO2可得到CaCO3,则向Ca(ClO)2溶液中通入少量SO2可得到CaSO3 |
| C.由O2与Li加热生成Li2O,则O2与Na加热生成Na2O |
| D.有Fe与S加热生成FeS,则Cu与S加热生成Cu2S |