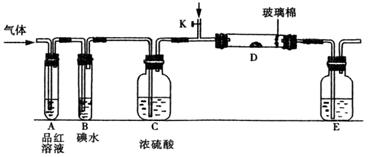
题目内容
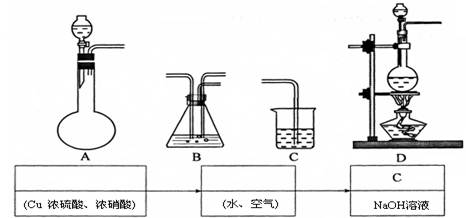
(14分)、实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下:
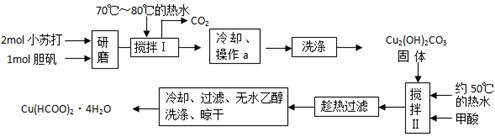
回答下列问题:
⑴小苏打和胆矾一起研磨的目的是 。
⑵生成碱式碳酸铜[Cu2(OH)2CO3]的离子方程式为 __ 。
⑶操作a的名称是 __ ,该操作使用的玻璃仪器有 __ 。
⑷证明碱式碳酸铜沉淀已经洗涤充分的实验操作方法是 __ ;
⑸“趁热过滤”的原因是 __ ;
⑹用无水乙醇洗涤晶体的目的是 __ 。

回答下列问题:
⑴小苏打和胆矾一起研磨的目的是 。
⑵生成碱式碳酸铜[Cu2(OH)2CO3]的离子方程式为 __ 。
⑶操作a的名称是 __ ,该操作使用的玻璃仪器有 __ 。
⑷证明碱式碳酸铜沉淀已经洗涤充分的实验操作方法是 __ ;
⑸“趁热过滤”的原因是 __ ;
⑹用无水乙醇洗涤晶体的目的是 __ 。
⑴加快反应速率
⑵2Cu2+ + 4HCO3— = Cu2 (OH)2CO3 ↓ +3CO2 + H2O
⑶过滤 玻璃棒、漏斗、烧杯
⑷取最后滤出的洗涤液少许,加入盐酸酸化的BaCl2溶液,无明显现象
⑸防止甲酸铜结晶而损失
⑹除去甲酸并减少甲酸铜晶体损失
⑵2Cu2+ + 4HCO3— = Cu2 (OH)2CO3 ↓ +3CO2 + H2O
⑶过滤 玻璃棒、漏斗、烧杯
⑷取最后滤出的洗涤液少许,加入盐酸酸化的BaCl2溶液,无明显现象
⑸防止甲酸铜结晶而损失
⑹除去甲酸并减少甲酸铜晶体损失
⑴两物质均易结块,将两固体一起研磨可增大反应物的接触面积,加快反应速率
(2)由流程图可看出,两反应物在热水中生成了Cu2(OH)2CO3,同时有CO2气体生成:2Cu2+ + 4HCO3— = Cu2 (OH)2CO3 ↓ +3CO2 + H2O
(3)固体与液体分离时可采用过滤的方法,所用的玻璃仪器包括:玻璃棒、漏斗、烧杯
(4)在生成Cu2 (OH)2CO3 的溶液中存在SO42—及Na+,故可能检验SO42—是否存在来判定沉淀是否洗涤干净:取滤液少许,加入盐酸酸化的BaCl2溶液,无明显现象,即可证明
(5)蒸发浓缩后甲酸铜的浓度比较高,如果冷却至常温会以晶体的形式析出,故要“趁热”过滤;
(6)甲酸可溶于乙醇中被除去,同时甲酸铜不溶于乙醇,可减小产品损失,故选用无水乙醇洗涤晶体
(2)由流程图可看出,两反应物在热水中生成了Cu2(OH)2CO3,同时有CO2气体生成:2Cu2+ + 4HCO3— = Cu2 (OH)2CO3 ↓ +3CO2 + H2O
(3)固体与液体分离时可采用过滤的方法,所用的玻璃仪器包括:玻璃棒、漏斗、烧杯
(4)在生成Cu2 (OH)2CO3 的溶液中存在SO42—及Na+,故可能检验SO42—是否存在来判定沉淀是否洗涤干净:取滤液少许,加入盐酸酸化的BaCl2溶液,无明显现象,即可证明
(5)蒸发浓缩后甲酸铜的浓度比较高,如果冷却至常温会以晶体的形式析出,故要“趁热”过滤;
(6)甲酸可溶于乙醇中被除去,同时甲酸铜不溶于乙醇,可减小产品损失,故选用无水乙醇洗涤晶体

练习册系列答案
相关题目

 ;
;