��Ŀ����
4����֪���Ȼ�ѧ����ʽ����H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-285.8kJ/mol
��H2O��g��=H2��g��+$\frac{1}{2}$O2��g����H=+241.8kJ/mol
��CO��g��=C��s��+$\frac{1}{2}$O2��g����H=+110.5kJ/mol
��C��s��+O2��g��=CO2��g����H=-393.5kJ/mol
�ش��������⣺
��1��������Ӧ�����ڷ��ȵ��Ǣ٢ܣ�
��2��H2��ȼ����Ϊ285.8kJ/mol��C��ȼ����Ϊ393.5kJ/mol��
��3��ȼ��10g H2����Һ̬ˮ���ų�������Ϊ1429kJ��
��4��д��COȼ���ȵ��Ȼ�ѧ����ʽ��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283 kJ•mol-1��
���� ��1�����ȷ�Ӧ�ʱ�С���㣬���ȷ�Ӧ�ʱ�����㣬�ݴ˽��
��2����25���϶ȣ�101 kPaʱ��1 mol��ȼ����ȫȼ�������ȶ��Ļ�����ʱ���ų������������������ʵ�ȼ���ȣ�
��3�������Ȼ�ѧ����ʽ�ټ��㣻
��4�����ݸ�˹���ɣ������֪����ʽ����Ŀ�귽�̽��
��� �⣺��1���١�H��0�ķ�Ӧ���ڷ��ȷ�Ӧ����H��0�ķ�Ӧ�������ȷ�Ӧ�����ݸ������Ȼ�ѧ����ʽ��֪���٢��ĸ���Ӧ�ġ�H��0���ڷ��ȷ�Ӧ��
�ʴ�Ϊ���٢ܣ�
��2������ȼ���ȵĶ���֪��H2ȼ��ʱ����Һ̬ˮ���ȶ�������H2��g��+$\frac{1}{2}$O2��g���TH2O��l������H=-285.8kJ•mol-1 ����������ȼ���Ȼ�ѧ����ʽ����ȼ���ȡ�H=-285.8kJ•mol-1��������̼��һ����̼�ȶ�����C��s��+O2��g��=CO2��g����H=-393.5kJ•mol-1��C��ȼ����Ϊ393.5 kJ•mol-1��
�ʴ�Ϊ��-285.8kJ•mol-1��393.5 kJ•mol-1��
��3�����Ȼ�ѧ����ʽ�ٿ�֪
H2��g��+$\frac{1}{2}$O2��g���TH2O��l�� Q
2g 285.8kJ
10g 1429kJ
�ʴ�Ϊ��1429kJ��
��4��ȼ����ָ1mol��ȼ����ȫȼ�������ȶ��Ļ�����ʱ���ų�������������+�۵�CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283 kJ•mol-1��COȼ���ȵ��Ȼ�ѧ����ʽΪ��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283 kJ•mol-1��
�ʴ�Ϊ��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283 kJ•mol-1��
���� ���⿼���˵���ʵĵ��롢�ʱ��뷴Ӧ���ȡ����ȵĹ�ϵ��ȼ���ȵĶ��壬��˹���ɵ�Ӧ�ã���Ŀ�ѶȲ�������ȼ������ע�⣺������1mol�����ʣ��������ɵ�����������ȶ���


| A�� | ����ˮ��CCl4 | B�� | ���� | ||
| C�� | �Ƚ������ε����ȶ��� | D�� | ��ȥCO��CO2 |
| A�� | 0.20mol | B�� | 0.21mol | C�� | 0.22mol | D�� | 0.23mol |
| A�� | AlCl3��Һ�м������ϡ��ˮ��Al3++4NH3•H2O�TAlO2-+4NH4++2H2O | |
| B�� | ��NH4��2Fe��SO4��2��Һ�����NaOH��Һ��Ӧ��Fe��OH��2��Fe2++2OH-�TFe��OH��2�� | |
| C�� | ����ʯ��ˮ�еμ�����NaHCO3��Ca2++2OH++2HCO3-�TCaCO3��+2H2O+CO32- | |
| D�� | ��Mg��HCO3��2��Һ�м�������� NaOH��Һ��Mg2++2HCO3-+4OH-�TMg��OH��2��+2CO32-+2H2O |
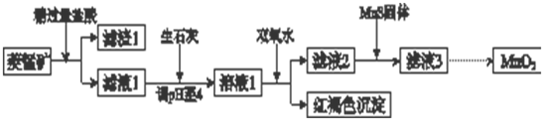
��֪��
�����������������pH
| Mn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
| ��ʼ����ʱ | 8.3 | 6.3 | 2.7 | 4.7 |
| ��ȫ����ʱ | 9.8 | 8.3 | 3.7 | 6.7 |
�ش��������⣺
��1�������ʵ����̿�ʹ��ǰ�轫����飬��ҪĿ��������Ӵ��������߷�Ӧ���ʣ������ܽ�MnCO3�Ļ�ѧ����ʽ��MnCO3+2HCl=MnCl2+CO2��+H2O��
��2������Һ1�м���˫��ˮʱ����Ӧ�����ӷ���ʽ��2Fe2++H2O2+4H2O=2Fe��OH��3��+4H+��
��3����Һ2�м����Թ��������ܵ����MnS���Գ�ȥCu2+����Ӧ�����ӷ���ʽ��MnS+Cu2+=Mn2++CuS��
��4����MnCl2ת��ΪMnO2��һ�ַ���������������������������ữ��NaClO3��Һ��MnCl2�������÷�Ӧ�����ӷ���ʽΪ��
��Mn2++��ClO3-+��4H2O=��Cl2����+��5MnO2+��8H+��
��5����MnCl2ת��ΪMnO2����һ�ַ����ǵ�ⷨ��
������MnO2�ĵ缫��Ӧʽ��Mn2+-2e-+2H2O=MnO2+4H+��
����ֱ�ӵ��MnCl2��Һ������MnO2��ͬʱ���������Cl2������Cl2�IJ����ǽ���ʪ�ĵ��۵⻯����ֽ������������������ֽ������֤����Cl2���ɣ�
����������MnCl2��Һ�м���һ������Mn��NO3��2��ĩ������Cl2��������ԭ�����������������£�����Mn2+Ũ��[������c��Mn2+��/c��Cl-��]��������Mn2+�ŵ磨������Cl-�ŵ磩��
| A�� | ����������ʹ���Ը��������Һ��ɫ | |
| B�� | ��ˮ��ʹ������ɫ | |
| C�� | Ũ������ʹʯ����Һ��ɫ | |
| D�� | ������ʹƷ����Һ��ɫ |
| A�� | ������ָ��������ͬ���� | |
| B�� | ������ָ ��������ͬ����������ͬ���� | |
| C�� | ������ָ����һ����Ŀ�����Ӻ�һ����Ŀ�����ӵ�һ��ԭ�� | |
| D�� | ������ָ��������ͬ�������������ͬ���� |