题目内容
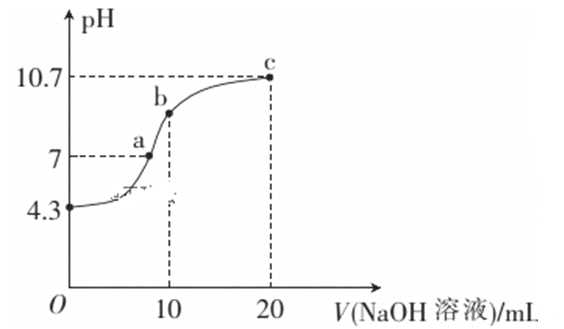
【题目】在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mf2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31
Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
A. Fe3+ B. Cr3+ C. Zn2+ D. Mg2+
【答案】A
【解析】
已知Fe3+、Cr3+、Zn2+、Mg2+四种离子浓度均为0.01 mol·L-1,根据四种沉淀物的Ksp,分别计算出四种离子开始沉淀时的OH- 浓度,然后在计算pH,据此进行分析。
根据金属离子的浓度和溶度积常数可以知道,四种离子开始沉淀时的OH- 浓度分别是:![]() =6.38×10-13mol/L,
=6.38×10-13mol/L,![]() =4.12×10-10mol/L,
=4.12×10-10mol/L,![]() =3.16×10-8mol/L,
=3.16×10-8mol/L,![]() =4.241×10-5mol/L,所以当氢氧化物开始沉淀时,铁离子所需溶液的pH最小,Mg2+所需pH最大;D正确;
=4.241×10-5mol/L,所以当氢氧化物开始沉淀时,铁离子所需溶液的pH最小,Mg2+所需pH最大;D正确;
综上所述,本题选D。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】下述实验不能达到预期实验目的是( )
序号 | 实验内容 | 实验目的 |
A | 将2.5gCuSO4.5H2O溶解在97.5g水中 | 配制质量分数为1.6%的CuSO4溶液 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 室温下,用pH试纸测定浓度为0.1mol.L-1NaClO溶液和0.1mol?L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
【题目】纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是
A | B | C | D |
|
|
|
|
银器用除锈剂见新 | 变形的金属香炉复原 | 古画水洗除尘 | 木器表面擦拭烫蜡 |
A. AB. BC. CD. D
【题目】对汽车加装尾气净化装置,可使有毒气体(CO、NO等)相互反应转化为无毒气体。
(1)2CO(g)+2NO(g)===2CO2(g)+N2(g) ΔH<0,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。
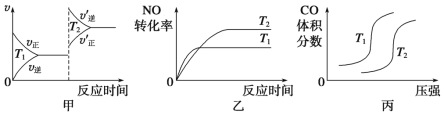
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。830℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。830℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为K=________________。
②乙容器中CO的平衡转化率为________。
比较甲、丙两容器中CO的平衡转化率:甲________丙(填“>”、“=”或“<”)。
③丙容器中,通过改变温度,使CO的平衡转化率降低,则温度________(填“升高”或“降低”)。
(3)以天然气为原料制备甲醇的方法有水煤气法和直接氧化法。涉及的反应有:
直接氧化法: 2CH4(g)+O2(g)=2CH3OH(g) ΔH1=-251kJ·mol-1
水煤气法: 2CH4(g)+O2(g)=2CO(g) +4H2(g) ΔH2=-70.8kJ·mol-1
CO(g) +2H2(g) =CH3OH(g) ΔH3
则ΔH3=__________kJ·mol-1