题目内容
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是( )
分析:根据电池总反应可知,电池工作时,负极为Al,发生氧化反应,电极反应式为Al-3e-+3OH-=Al(OH)3,正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,结合原电池的工作原理解答该题.
解答:解:A、正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,故A正确;
B、电池工作时,电流由正极流向负极,即从铂电极沿导线流向铝电极,故B错误;
C、Al不断反应,不断溶解,所以一段时间后,更换铝板就可以继续使用,故C正确;
D、铂做成网状的目的是增大与氧气的接触面积,故D正确.
故选B.
B、电池工作时,电流由正极流向负极,即从铂电极沿导线流向铝电极,故B错误;
C、Al不断反应,不断溶解,所以一段时间后,更换铝板就可以继续使用,故C正确;
D、铂做成网状的目的是增大与氧气的接触面积,故D正确.
故选B.
点评:本题考查化学电源知识,题目难度中等,注意原电池的两极上的变化以及原电池原理.

练习册系列答案
相关题目
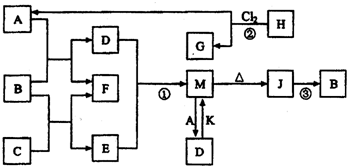 (1)C中存在的化学键类型为
(1)C中存在的化学键类型为