题目内容
我国首创的海洋电池以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列说法正确的是( )
分析:根据电池总反应可知,电池工作时,负极为Al,发生氧化反应,电极反应式为Al-3e-+3OH-=Al(OH)3,正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,结合原电池的工作原理解答该题.
解答:解:A.电池工作时,电流从正极铂电极沿导线流向负极铝电极,故A错误;
B.铂做成网状的目的是增大与氧气的接触面积,加快反应速率,故B正确;
C.当海水饱和时,继续加入氯化钠,溶液成为过饱和溶液,离子浓度不变,所以海水的导电性不变,故C错误;
D.负极上电极反应式为Al-3e-+3OH-=Al(OH)3,故D错误;
故选B.
B.铂做成网状的目的是增大与氧气的接触面积,加快反应速率,故B正确;
C.当海水饱和时,继续加入氯化钠,溶液成为过饱和溶液,离子浓度不变,所以海水的导电性不变,故C错误;
D.负极上电极反应式为Al-3e-+3OH-=Al(OH)3,故D错误;
故选B.
点评:本题考查化学电源知识,题目难度中等,注意原电池两极上的变化以及原电池原理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
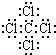
 (1)C中存在的化学键类型为
(1)C中存在的化学键类型为