题目内容
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
(1)H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为______ 元酸,其电离方程式是__________.
(2)H3PO2是中强酸,写出其与NaHCO3溶液反应的离子方程式______________________.
(3)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银.
①H3PO2中,P元素的化合价为__________;
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则其氧化产物为_____________;(填化学式)
(4)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式____________.
【答案】 一 H3PO2![]() H++ H2PO2﹣ H3PO2+HCO3﹣=H2PO2﹣+CO2↑+H2O +1 H3PO4 2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑
H++ H2PO2﹣ H3PO2+HCO3﹣=H2PO2﹣+CO2↑+H2O +1 H3PO4 2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑
【解析】(1)H3PO2与足量的NaOH溶液反应,生成NaH2PO2,说明H3PO2只能电离出一个氢离子,所以H3PO2是一元酸,电离方程式为:H3PO2![]() H+ + H2PO2﹣;故答案为:一;H3PO2
H+ + H2PO2﹣;故答案为:一;H3PO2![]() H+ + H2PO2﹣;
H+ + H2PO2﹣;
(2)H3PO2是中强酸,与NaHCO3溶液反应生成二氧化碳和NaH2PO2,其反应离子方程式为:H3PO2+HCO3﹣=H2PO2﹣+CO2↑+H2O;故答案为:H3PO2+HCO3﹣=H2PO2﹣+CO2↑+H2O;
(3)①H3PO2中,总化合价为0,其中氢元素为+1价,氧元素为-2价,则P元素的化合价为:+1价;故答案为:+1;
②利用H3PO2进行化学镀银反应中,反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,故答案为:H3PO4;
(4)白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,反应方程式为2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】在呼吸面具和潜水艇中可用过氧化钠作为供养剂。请选择适当的化学试剂和实验 用品,用下图中的实验装置进行试验,证明过氧化钠可作供养剂。
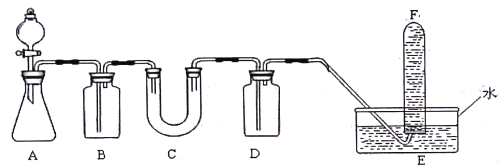
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:__________________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入试剂的目的 |
B | 饱和NaHCO3溶液 | ____________ |
C | _________________ | ____________ |
D | _________________ | ____________ |