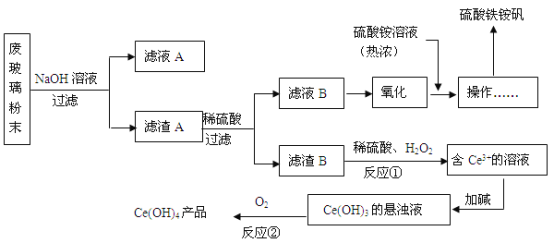
题目内容
【题目】海水中含有丰富的资源,其中包括钠离子、氯离子、镁离子等。
(1)氯元素位于元素周期表第________列,写出氯原子的最外层电子排布式________________, 最外层电子所占据的轨道数为________ 个,氯原子核外共有________种能量不同的电子。
(2)列举能说明Mg的金属性比Na弱的一个实验事实__________________。
(3)相同压强下,部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/℃ | 1266 | 1534 | 183 |
试解释上表中熔点SiF4远低于NaF的原因_________________________
(4)氨水是实验室最常用的弱碱,向滴有少量酚酞试液的稀氨水,加入少量的NH4AC晶体,若观察到________________则可证明一水合氨是弱电解质。请再提出一个能证明一水合氨是弱电解质的实验方案 ______________________________________
(5)向盐酸中滴加氨水至过量,该过程所发生反应的离子方程式为___________________
在滴加的整个过程中离子浓度大小关系可能正确的是(______)
a.c(C1-)=c(NH4+)>c(H+)=c(OH-) b.c(C1-)>c(NH4+)= c(OH-) >c(H+)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
【答案】17 ![]() 4 5 Na在常温下与水剧烈反应,Mg在常温下不与水反应 NaF为离子晶体,SiF4为分子晶体,故SiF4的熔点低 溶液红色变浅 测量0.01mol/L的pH 如pH=12则一水合氨为强碱;如pH<12则为弱碱
4 5 Na在常温下与水剧烈反应,Mg在常温下不与水反应 NaF为离子晶体,SiF4为分子晶体,故SiF4的熔点低 溶液红色变浅 测量0.01mol/L的pH 如pH=12则一水合氨为强碱;如pH<12则为弱碱 ![]() ac
ac
【解析】
(1)氯原子位于周期表中第三周期第ⅦA族。根据氯原子核外有17个电子结合构造原理,其核外电子排布式为![]() ;
;
(2) Na在常温下与水剧烈反应,Mg在常温下不与水反应;
(3)根据晶体类型SiF4为分子晶NaF为原子晶体解答;
(4)如果氨水是弱碱,则存在电离平衡,加入含有相同离子的盐能改变平衡的移动,则溶液的颜色发生变化,如果不变化,则证明是强碱;
(5)向盐酸中滴加氨水至过量,离子方程式:![]() ,溶液中的离子浓度根据电荷守恒和物料守恒判断。
,溶液中的离子浓度根据电荷守恒和物料守恒判断。
(1)氯原子位于周期表中第三周期第ⅦA族。根据氯原子核外有17个电子结合构造原理,其核外电子排布式为![]() ;最外层电子排布式为
;最外层电子排布式为![]() ,占据2个轨道;不同层级的电子能量不同则氯原子核外共有5种能量不同的电子。故答案为:17;
,占据2个轨道;不同层级的电子能量不同则氯原子核外共有5种能量不同的电子。故答案为:17;![]() ;4;5;
;4;5;
(2)Na在常温下与水剧烈反应,Mg在常温下不与水反应由此可以判断Mg的金属性比Na弱,故答案为:Na在常温下与水剧烈反应,Mg在常温下不与水反应;
(3)NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,故答案为:NaF为离子晶体,SiF4为分子晶体,故SiF4的熔点低;
(4)如果氨水是弱碱,则存在电离平衡![]() 加入NH4AC晶体NH4+浓度增大平衡逆移OH-浓度减小溶液红色变浅;还可以测量0.01mol/L的pH 如pH=12则一水合氨为强碱;如pH<12则为弱碱。故答案为:溶液红色变浅;测量0.01mol/L的pH 如pH=12则一水合氨为强碱;如pH<12则为弱碱;
加入NH4AC晶体NH4+浓度增大平衡逆移OH-浓度减小溶液红色变浅;还可以测量0.01mol/L的pH 如pH=12则一水合氨为强碱;如pH<12则为弱碱。故答案为:溶液红色变浅;测量0.01mol/L的pH 如pH=12则一水合氨为强碱;如pH<12则为弱碱;
(5))向盐酸中滴加氨水至过量,离子方程式:![]() ,
,
a根据电荷守恒![]() ,如溶液呈中性,c(H+)=c(OH-),则有c(Cl-)=c(NH4+),此时氨水应过量少许,故a正确;
,如溶液呈中性,c(H+)=c(OH-),则有c(Cl-)=c(NH4+),此时氨水应过量少许,故a正确;
b、根据电荷守恒![]() ,当c(NH4+)=c(OH-),c(H+)=c(Cl-)故b错误;
,当c(NH4+)=c(OH-),c(H+)=c(Cl-)故b错误;
c、体系为NH4Cl溶液和NH3·H2O,氨水过量较多时,溶液呈碱性:c(NH4+)>c(OH-)>c(Cl-)>c(H+),故c正确;
d、盐酸是一元强酸,氢离子被氨水中和一部分,所以c(H+)不可能大于c(Cl-),故d错误;故选ac。
故答案为:![]() ;ac。
;ac。

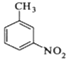
【题目】对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
![]()
![]()
![]() +
+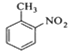 +
+
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是___________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于________层(填“上”或'下”)。
(3)5% NaHCO3溶液洗涤的目的是__________
(4)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂)/n(甲苯) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为_______________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是_________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_____________。
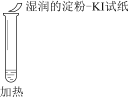
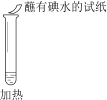
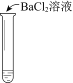
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化