题目内容
【题目】某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断。将5.4g铝片投入500mL 0.5 mol·L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图。
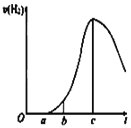
(1)关于图像的描述不正确的是______
①a→c段产生氢气的速率增加较快可能是表面的氧化膜逐渐溶解,加快了反应的速率
②a→c段产生氢气的速率增加较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生氢气的速率逐渐下降可能是铝片趋于消耗完全
(2)书写O→a段所对应的离子方程式___________________________
(3)若其他条件不变,现换用500mL1mol·L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol·L-1硫酸的快,可能的原因是_______
①盐酸中c(H+)的浓度更大 ②Cl—有催化作用 ③SO42—有催化作用
④SO42—有阻化作用 ⑤Al3+有催化作用
(4)根据所学,若要加快铝片与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②滴加少量CuSO4溶液;③将铝片剪成100条;④增加硫酸的浓度至18mol/L;⑤加入蒸馏水;⑥加入少量KNO3;
其中,你认为不合理的方案有_____________。
【答案】(1)③;(2)Al2O3+6H+=2Al3++3H2O;(3)②④;(4)④⑤。
【解析】
试题分析:(1)5.4gAl物质的量为0.2mol,500mL 0.5molL-1 的硫酸溶液中含硫酸0.25mol,根据反应方程式:2Al+3H2SO4= Al2(SO4)3+3H2↑可知二者反应的物质的量关系是:n(Al):n(H2SO4)=2:3,可知Al过量,能够将硫酸反应完全,①曲线a→c段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率,正确;②曲线由a→c段,产生氢气的速率增加较快的主要原因为该反应为放热反应,温度升高,反应速率加快,正确;③曲线由c以后,产生氢气的速率逐渐下降的主要原因为氢离子浓度减小,反应速率减小,错误;(2)书写O→a段所对应的反应是氧化铝与酸发生复分解反应,反应的离子方程式是Al2O3+6H+=2Al3++3H2O;(3)其他条件不变,现换用500mL 1molL-1盐酸,产生氢气速率普遍较使用500mL 0.5 molL-1硫酸的快,只能是氯离子起了催化作用或SO42-有阻化作用(使反应变慢),故答案为:②④;(4)①加入某种催化剂,加快反应速率,正确; ②滴加少量CuSO4溶液,Al与盐发生置换反应产生Cu,Cu、Al及硫酸构成原电池,可以使化学反应速率加快,正确;③将铝片换成铝粉,增大反应物的接触面积,反应速率增大,正确;④增加硫酸的浓度至18mol/L,发生钝化,反应速率减小,错误;⑤加入蒸馏水,稀释溶液,反应速率减慢,错误。故不合理的方案有④⑤。

 口算能手系列答案
口算能手系列答案