题目内容
【题目】乙苯是一种用途广泛的有机原料,可制备多种化工产品。
(一)制备苯乙烯(原理如反应I所示):
Ⅰ. 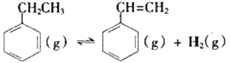 △H=+124kJ·mol-1
△H=+124kJ·mol-1
(1)部分化学键的键能如下表所示:
化学键 | C-H | C-C | C=C | H-H |
键能/ KJ/mol | 412 | 348 | X | 436 |
根据反应I的能量变化,计算X=_________。
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气。请用化学平衡理论解释通入水蒸气的原因:_________。
(3)已知吉布斯自由能△G=△H-T△S ,当△G < 0时反应可自发进行。由此判断反应I在_________(填“高温”或“低温”)更易自发进行。
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ. 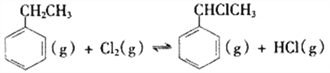 △H2>0
△H2>0
(4)T°C时,向10 L恒容密闭容器中充入2mol乙苯(g)和2 mol Cl2(g)发生反应Ⅱ,乙苯(或Cl2)、 α-氯乙基苯(或HCl)的物质的量浓度(c)随时间(t)变化的曲线如图所示:
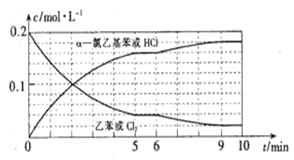
①0—2 min内,以HCl表示的该反应速率v(HCI)=_________。
②6 min时,改变的外界条件为_________,该条件下的平衡常数K的数值=_________。
③10 min时,保持其他条件不变,再向容器中充入1 mol乙苯、1 mol Cl2、1 molα-氯乙基苯和1mol HCl,则此时该反应v正_________v逆(填“>”、“<”或“=” );若12 min时反应再次达到平衡,则在0-12 min内,Cl2的转化率α=_________。(计算结果保留三位有效数字)
【答案】 612 该反应正向为气体分子数增大的反应,通入水蒸气需增大容器容积,减小体系压强,平衡正向移动,增大反应物的转化率 高温 0.05 molL-1min -1 升高温度 81 V正>V逆 86.7%
【解析】(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,设C=C键能为X,则△H=(5×412+348-3×412-X-436)kJmol-1=124kJmol-1,解得X=612kJ/mol;(2)降低压强,平衡向体积增大的方向移动,制备苯乙烯的正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;(3)反应自发进行需要满足,△H-T△S<0,依据题干条件可知,制备苯乙烯的正反应为气体分子数增大的反应,△S>0,正反应吸热,△H=+124kJ/mol>0,所以反应一定是在高温条件下才能自发进行;(4)①T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,2min时氯化氢的浓度是0.1mol/L,则用氯化氢表示的反应速率是0.1mol/L÷2min=0.05molL-1min -1;②制备α-氯乙基苯的正反应为吸热反应,反应前后气体的体积不变,6min时,乙苯、Cl2的浓度在减小,而α-氯乙基苯和HCl的浓度在增加,反应向正反应方向移动,只能是升高温度;该温度下达到平衡,依据题干条件可知,c(HCl)=0.16mol/L,n(HCl)=1.6mol,

起始(mol) 2 2 0 0
转化(mol) 1.8 1.8 1.8 1.8
平衡(mol) 0.2 0.2 1.8 1.8
反应前后体积不变,可以用物质的量代替浓度计算平衡常数,则平衡常数为K=![]() ;③10min时,乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度分别为:0.02mol/L、0.02mol/L、0.18mol/L、0.18mol/L,此时乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度比为:1:1:9:9,保持其他条件不变,再向容器中充人1mol 乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,相当于增加反应物的浓度,平衡正向移动,正反应速率大于逆反应速率;设转化的乙苯物质的量浓度为x,则
;③10min时,乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度分别为:0.02mol/L、0.02mol/L、0.18mol/L、0.18mol/L,此时乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度比为:1:1:9:9,保持其他条件不变,再向容器中充人1mol 乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,相当于增加反应物的浓度,平衡正向移动,正反应速率大于逆反应速率;设转化的乙苯物质的量浓度为x,则

起始(mol/L) 0.3 0.3 0.1 0.1
转化(mol/L) x x x x
平衡(mol/L) 0.3-x 0.3-x 0.1+x 0.1+x
平衡常数为K=(0.1+x)×(0.1+x)/(0.3x)×(0.3x)=81,得x=0.26,所以氯气的转化率是![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】下表为元素周期表的一部分,请回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是________和________。
(2)表中最活泼的金属最高价氧化物的水化物化学式是________,非金属性最强的元素单质化学式是________ ,表中能形成两性氢氧化物的元素对应最高价氧化物化学式是_______ 。
(3)分别写出④元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的离子方程式:_____________________,_________________________。
(4)可以比较⑦与⑩单质氧化性的离子方程式为:_______________________。
(5)表中形成化合物种类最多的元素的元素符号是______,形成的种类繁多的这类化合物中,最简单的化合物的化学式是________。
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/mol·L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在1020 min内,以物质A表示的平均反应速率为______mol·L-1,50min时,v(正)_____(填“<” “>” 或“=”)v(逆)。
(2)020 min内,实验2比实验1的反应速率________(填“快”或“慢”),其原因可能是__________。
(3)实验3比实验1的反应速率____________(填“快”或“慢”),其原因是_______________。